Ángel González de la Flor
Fisioterapeuta en Hospital Universitario Quirón Madrid
Universidad Complutense de Madrid
RESUMEN
El objetivo de este artículo es revisar la eficacia de los ejercicios excéntricos en las tendinopatías aquileas, exponer los avances en cuanto a la fisiopatología de las tendinopatías y proponer un programa de ejercicios basados en la evidencia.
Se consultaron las bases de datos PubMed, PEDro y la Biblioteca Cochrane. La información se obtuvo a partir de ensayos clínicos randomizados y revisiones sistemáticas en lengua inglesa, realizados sobre sujetos diagnosticados de tendinopatía aquilea con sintomatología presente, sin patología o cirugía previa del tendón afectado.
Se ha evidenciado una mejora en cuanto a los signos y síntomas que presenta el paciente mediante el tratamiento con ejercicios excéntricos en el tendón de Aquiles frente a los resultados obtenidos con otros tratamientos conservadores o quirúrgicos.
Actualmente, siguen siendo desconocidos los mecanismos de acción por los que disminuye el dolor, la neovascularización o el volumen del tendón mediante los ejercicios excéntricos en el tendón.
En definitiva, existe evidencia moderada del ejercicio excéntrico en las tendinopatías aquileas. Los mecanismos a través de los cuales se produce alivio del dolor y la recuperación de la funcionalidad con este tipo de ejercicios siguen sin estar claros. Se necesitan más estudios para determinar los mecanismos de acción de este tipo de ejercicios para demostrar su eficacia.
Palabras clave: Tendinopatía aquilea, Tendón de Aquiles, ejercicio excéntrico.
ABSTRACT
The aim of this work is to evaluate the effectiveness degree of eccentric exercises in Achilles tendinopathy, present the advances of the tendinopathy physiopathology and propose an exercise program based on evidence.
The consult was from databases of PubMed, PEDro and the Cochrane Library. The information was obtained from randomized clinical trials and systematic reviews in English, performed on patients diagnosed with Achilles tendinopathy with symptoms present and no pathology or previous surgery of the affected tendon.
It has shown an improvement in the signs and symptoms presented by the patient through treatment with eccentric exercise in Achilles tendon against other conservative or surgical treatments. Actually, remain unknown mechanisms of action by which decreases pain, neovascularization or tendon thickness by eccentric exercise in the tendon.
In short, there is moderate evidence of eccentric exercise in Achilles tendinopathy. The mechanisms of pain relief and functional recovery with such exercises is remain unclear. Further studies are needed to determine the mechanisms of action of these exercises to demonstrate its effectiveness.
Keywords: Achilles Tendinopathy; Achilles Tendon; Eccentric exercise
INTRODUCCIÓN
En los últimos años se está demostrando que mediante ejercicios excéntricos mejoran los síntomas clínicos y alteraciones histológicas de la tendinopatía aquilea frente a los resultados obtenidos con otros tratamientos convencionales.
Se pretende aclarar la terminología a utilizar, es decir, diferenciar entre los términos ‘’tendinitis’’, ‘’tendinosis’’ y ‘’tendinopatía’’. Para obtener un buen y preciso diagnóstico fisioterápico es necesario asentar unas bases en cuanto a esta terminología y los procesos histopatológicos que van asociados a estos dos términos. Si hablamos de tendinitis nos estamos refiriendo a que ese tendón está inflamado, un proceso mediado por sustancias químicas inflamatorias que hasta el momento no se han hallado en los tendones afectados.
Por lo tanto este trabajó además de evidenciar la eficacia de los ejercicios excéntricos, también constará con una parte de demostración de los avances en la fisiopatología de las tendinopatías en el tendón de Aquiles.
Antecedentes
Para definir la tendinopatía aquílea primero tenemos que aclarar la terminología utilizada. ¿Por qué tendinopatía y no tendinitis?
Durante muchos años, y aún algunos profesionales sanitarios en la actualidad, han utilizado el término ‘’tendinitis’’ creyendo en la inflamación del tendón. En los últimos estudios en este tipo de patología se sugiere que no hay sustancias inflamatorias dentro del tendón cuando hablamos de tendinopatía sin patologías asociadas, por lo que el termino tendinitis sería incorrecto1. Además en 1998 Maffulli et al.2 propusieron el término tendinopatía como un conjunto de síntomas: dolor, hinchazón y alteración funcional del rendimiento y el término tendinosis como el conjunto de alteraciones histopatológicas que se producen en el tendón. Y ya en 2008 Craig Purdam y Jill Cook3, investigadores australianos muy reconocidos en todo el mundo por sus descubrimientos en la fisiopatología del tendón defendían la postura de que la Tendinopatía es un proceso degenerativo con 3 fases bien diferenciadas:
- Tendinopatía reactiva
- Tendón deteriorado
- Tendinopatía degenerativa
En la tendinopatía existen cambios histológicos en el tendón que están provocados por un exceso de carga que no es capaz de soportar. Este aumento de carga puede deberse a un esfuerzo repetido, a un estiramiento excesivo del músculo, o simplemente a una mala postura mantenida que pida una contracción muscular más tiempo del debido.
La primera de estas tres fases está marcada por el aumento de actividad de los tenocitos (células de los tendones) y la aparición de unas proteínas (Proteoglicanos) entre los tenocitos, comunicados entre sí mediante estímulos mecánicos, transmitiendo la información de exceso de carga a todo el tendón.
La aparición de estas proteínas es la que generaba la confusión de tendón inflamado por un aumento de volumen, puesto que no hay agentes inflamatorios implicados en éste proceso. Estos cambios iniciales en el tendón pueden ocurrir debido a la rápida adaptación necesaria hasta los cambios a largo plazo en la estructura y propiedades mecánicas del tendón. La respuesta rápida es posible a los grandes proteoglicanos asociados a la tendinopatía y algunas glicoproteínas. Estas últimas pueden ser reguladas en un intervalo de tiempo que varían de minutos a unos pocas días, mucho más rápido que los proteoglicanos pequeños del tendón normal (20 días)3.
Por lo tanto, la respuesta reactiva es una adaptación a corto plazo a la sobrecarga que es sometido el tendón, reduciendo el estrés y aumentando la rigidez del tendón.
En esta fase el tendón tiene el potencial de revertir a su estado normal si la sobrecarga se reduce suficientemente, o si es sometido a sesiones de tratamiento.
La segunda fase describe el intento de reparación del tendón, similar a la tendinopatía reactiva pero con una mayor degradación de la matriz. Hay un incremento global en el número de células, así como algunos miofibroblastos, resultando en un incremento marcado en la producción de proteínas (proteoglicanos y colágeno)3.
El aumento de proteoglicanos resulta en una separación del colágeno y la desorganización de la matriz.
Los cambios son algo más focales y la matriz está más desorganizada que en la etapa reactiva. Puede haber un aumento en vascularización y formación neuronal asociada.
La tercera fase, es la más común, se describe claramente en la literatura, como la progresión y cambios de la matriz y de las células. Hay áreas de muerte celular debido a apoptosis, traumatismos o agotamiento de los tenocitos. Como resultado, se han descrito áreas acelulares, grandes áreas de la matriz extracelular están desordenadas, llenos de vasos, y productos de la degradación del colágeno en la matriz. Y por último, hay poca capacidad de reversibilidad de los cambios patológicos en esta etapa3.
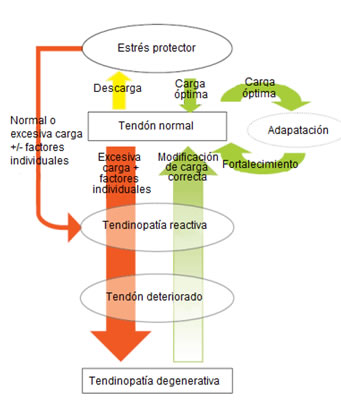
Estas tres fases vienen indicadas a continuación en el siguiente recuadro (Fig.1).

Fig.1 Este modelo abarca la transición normal del tendón en el proceso de tendinopatía generativa y resalta el potencial de reversibilidad en fases tempranas del proceso. (Cook J et al, 2009 modificada)3.
Haciendo referencia a la aparición del dolor en éste proceso, han podido demostrar que no necesariamente más lesión implica más dolor. Más bien al contrario, el dolor suele ser mucho mayor en la primera fase, como respuesta del cuerpo a algo que le está perjudicando. Siempre dependiendo del umbral del dolor de cada persona3.
Definición y epidemiología:
Proceso degenerativo con hallazgos histopatológicos (aumento del volumen del tendón, alteración en la distribución de colágeno y formación de tenocitos, y neovascularización) asociado a dolor y limitación funcional4-5. Se da en personas que realizan actividad física como carrera o saltos repetidos, pero también en personas que no realizan ninguna actividad deportiva. Teniendo una incidencia de un 5’9% en población sedentaria y hasta un 50% de deportistas de élite6, y una prevalencia de 7-40% en población atlética7.
Anatomía del tendón de Aquiles
El tendón de Aquiles es el más grueso y fuerte tendón en el cuerpo humano. Está formado por los grastrocnemios, lateral y medial,el sóleo y tendón del plantar. Además dependiendo de la forma del tendón podremos encontrarlos con forma aplanada o redondeada. El Tendón de Aquiles tiene una forma redondeada, es un tendón diseñado sobre todo para soportar grandes fuerzas tensionales con ausencia de vaina sinovial pero con una capa de células ricamente vascularizada o Paratendón, que se origina en el músculo Tríceps Sural hasta su inserción en el Calcáneo en un trayecto descendente, en el que sus fibras sufre una rotación de 90º, siendo más marcada a unos 5-6 cm desde su origen, siendo la zona de lesión más frecuente13.
Histología
El tendón está formado principalmente por tenocitos (fibrocitos especializados) y tenoblastos que comprenden el 90-95% de los elementos celulares del tendón, además de condrocitos, células vasculares y células musculares lisas formando el 5-10% restante. El colágeno y la elastina forman la mayor parte de la matriz extracelular, que comprende 70% y 2% del peso seco del tendón, respectivamente. Aunque la elastina puede someterse a un 200% de deformación de su longitud sin carga, el aumento de la proporción de elastina reduciría la eficiencia de la fuerza de disipación del músculo al hueso. Las fibras de colágeno están organizadas en haces paralelos que contienen nervios, vasos sanguíneos y linfáticos, formando fascículos. Los fascículos están rodeados por un endotendón y se agrupan para formar el tendón macroscópico. El tendón está envuelto por epitendón, que a su vez está rodeado por paratendón (Fig. 2). El paratendón y epitendón están separados por una capa delgada de fluido para reducir la fricción durante el movimiento del tendón. En un tendón de Aquiles normal se observa un patrón de células organizadas donde los tenocitos aparecen como células estrelladas en secciones transversas, agrupándose en filas longitudinales. El colágeno tipo I comprende más de 90% del tendón. Sin embargo, cuando hay una tendinopatía se produce una mayor proporción de colágeno tipo III in vitro, que es menos resistente a la tracción fuerzas13.

Fig. 2 Esquema de la composición del tendón. Subfascículos y fascículos rodeados de endotendon, agrupándose y rodeados de epitendon, a su vez rodeado de paratendón. (Doral MN et al, 2010)13.
Inervación:
Los tendones se cree que reciben su inervación sensorial desde que se recubre por los nervios superficiales o nervios de profundidad adyacente. El tendón de Aquiles se inerva en particular del nervio sural con un suministro más pequeño desde el nervio tibial (S1-S2). Las terminaciones nerviosas se unen para formar un plexo longitudinal que aporta fibras aferentes en la gran mayoría. Los receptores aferentes están en gran parte cerca de la unión osteotendinosa y comprenden los cuatro tipos de receptores: tipo I: Ruffini (corpúsculos receptores de presión), tipo II: Vater-Paccinian (corpúsculos sensibles a movimiento),
tipo III: mecanorreceptores tendinosos de Golgi y tipo IV: terminaciones nerviosas libres que funcionan como receptores de dolor13.
Vascularización:
El suministro de sangre de los tendones proviene de tres fuentes: la unión musculotendinosa, en tejido circundante y la unión osteotendinosa. La predominante es una rama de la arteria recurrente de la arteria tibial posterior, que abastece principalmente a los tejidos peritendinosos. La arteria peronea, probablemente a través de anastomosis con la arteria tibial posterior, hacen pequeñas contribuciones a nivel medio del tendón; la arteria tibial anterior no parece estar implicada. Mientras que el paratendón se sabe que es altamente vascularizado, existe desacuerdo en cuanto a si los buques están uniformemente distribuidos a lo largo la longitud del tendón o permitir el flujo de sangre a mayor el sitio de inserción. La territorios vasculares pueden simplemente clasificarse en tres, con la sección media suministrada por la arteria peronea (menos vascularizada), y las secciones proximal y distal vascularizadas por la arteria tibial posterior. A pesar de las discrepancias en la literatura en cuanto a su presencia, esta área de hipovascularización relativa en la porción media del tendón es donde más problemas se producen13.
Etiología de la tendinopatía aquilea
Aclarados estos apartados de anatomía y biomecánica ya podemos entender mejor el funcionamiento del tendón de Aquiles y aproximarnos a su etiología. Aunque ésta todavía sea desconocida y no estén muy claros los factores de riesgo. Clásicamente se ha atribuido un factor mecánico por sobrecarga a las tendinopatías, pero posiblemente sea un problema multifactorial donde deberemos observar una serie de factores de riesgo. Kannus P15. en 1997 ya nos ofreció una serie de factores relacionados con la aparición de tendinopatías. Dividió los factores en intrínsecos y extrínsecos a las tendinopatías crónicas en el deporte15.
También es una patología que se caracteriza porque la aparición del dolor es tardía cuando en el tendón ya se han producido una serie de cambios tisulares que cronifican la lesión y como dicen Fredberg et al.16 la tendinopatía es como un iceberg, donde el dolor es la punta de ese ‘’iceberg’’. En su estudio se encontraron el 30% de tendones estudiados con alteraciones ecográficas sin sintomatología, lo que explica que lleguen a producirse roturas de tendones sin previo aviso16 (Fig. 3).

Fig. 3 El ‘’iceberg’’ de la tendinopatía (Fredberg U et al, 2008 modificada)16.
Histopatología
Un tendón normal es brillante, de color blanco y tiene una textura firme fibroelástica. Al contrario, un tendón afectado es de color gris o marrón, y es blando, delgado y frágil.
Los paquetes de colágeno se encuentran desorganizados, los núcleos son oscuros y redondos, y en mayores cantidades. Esto contrasta con los haces de colágeno paralelos bien organizados que se encuentran en un tendón normal17.
A nivel de microscopio electrónico las fibras de colágeno en el tendón afectado son anguladas, varían en diámetro y orientación. Se ha encontrado un incremento en la cantidad de agua en las áreas de tendinopatía y el contenido de colágeno en ellas era inferior al de las zonas cercanas o al tendón sano, tratándose de un tejido inmaduro con falta de equilibrio entre el colágeno tipo III (menos elástico) y tipo I.
Hay cambios relacionados con la hipoxia, incluyendo vacuolas lipídicas y lisosomas agrandados17.
Estudios inmunohistoquímicos demuestran la presencia del neuropéptido sustancia P (SP), conocido principalmente por su participación en los mecanismos del dolor aferente, además de tener efectos eferentes en el que puede jugar un papel en la patología del tendón, tal como la estimulación de angiogénesis. En tejido humano y con ratones en el tendón de Aquiles, se mostró que los tenocitos pueden expresar el mRNA para SP (TAC1), y que el receptor para SP (neuroquinina-1 receptor [NK-1 R]) se encuentra también en los tendones humanos, con una expresión más notable en los tendones afectados. Esto hace pensar que la producción de SP por parte del tenocito, en respuesta a un estrés mecánico por carga, incremente la proliferación celular y la angiogénesis a través de un bucle autocrino con su receptor NK-1 R18-20.
También se ha hallado una mayor concentración de sustancias moduladoras del dolor además de la SP como glutamato, catecolaminas, lactato o acetilcolina en tendinopatía crónica aquilea en comparación con el dolor en relación con tendones no afectados 17,21.
Asociado a estas sustancias nociceptivas, en el proceso degenerativo del tendón también se ha hallado como se ha comentado anteriormente zonas de neovascularización o angiogénesis dentro del tendón siendo una posible causa también del dolor (Fig.5). Este proceso se produce por un intento de regeneración del tendón22. Se ha relacionado que el aumento del flujo capilar del tendón agrava la neovascularización, provocando más dolor. Así como una oxigenación baja provoca mayor acidosis, aumentando los niveles de lactato.
Por eso se tiene que procurar mantener un flujo capilar bajo y una buena oxigenación del tendón23.
Otro de los cambios histológicos que se producen en el tendón es una alteración estructural a nivel de los tenocitos. En los últimos años se ha demostrado que hay diferencias a nivel de la estructura, en las densidades celulares de volumen y en los niveles de expresión de diversos genes implicados en la regulación de las proteínas de la matriz en un mismo tendón donde había unas zonas afectadas y otras no.
Las principales conclusiones fueron las diferencias en la composición de las estructuras de colágeno con la región afectada con un significativamente mayor número de fibrillas de pequeño calibre (diámetro 10-40 nm) en comparación a la región del tendón sano (Fig. 4). Además, la región afectada tuvo una mayor fracción de volumen de las células, compatible con un mayor número de células por unidad de volumen24.

Fig. 4 Tendón afectado con fibrillas de pequeño calibre (izquierda) y tendón no afectado (derecha).
(Pingel J et al, 2012 modificada)24.
Resumiendo, podemos decir que tanto la alteración en la distribución de colágeno, la neovascularización, la presencia de sustancias nociceptivas (Sustancia P o Glutamato) y los cambios en el tamaño de los tenocitos son los cambios histológicos más significativos que podemos encontrar en las tendinopatías y en este caso en el tendón de Aquiles.
Frente a estos cambios histopatológicos dentro del tendón se ha observado que el entrenamiento con ejercicios excéntricos tiene varios efectos a nivel celular:
- Incrementa la síntesis de colágeno en el tendón en mayor medida que los ejercicios concéntricos25.
- Activa la degradación de la matriz extracelular en menor medida que el concéntrico26.
- En fases iniciales, el entrenamiento excéntrico activa la angiogénesis, pero a largo plazo reduce la presencia de capilares en el tendón en mayor medida que el concéntrico27 (Fig. 5).

Fig.5 Disminución de la neovascularización en la imagen derecha mediante ejercicios excéntricos. (Alfredson H et al, 2004)34.
Diagnóstico / Valoración
Explicada la histopatología y cómo actúan los excéntricos en las tendinopatías, además de las posibles afecciones en el tendón de Aquiles y sus estructuras adyacentes, en este punto del trabajo nos vamos a centrar en concreto en el diagnóstico de la tendinopatía aquilea: inserción del tendón y en la porción media del tendón.
Como ya se ha explicado anteriormente en la inserción del tendón los síntomas son dolor, rigidez y en ocasiones aumento del volumen del tendón.
En la porción media del tendón (entre 2-7 cm por encima de la inserción) los síntomas suelen ser dolor, aumento de volumen e impotencia funcional. Su histopatología suele ser la propia de una tendinopatía, un proceso degenerativo que puede cursar con síntomas o asintomática.
Rara vez se suele dar una tendinopatía en la unión musculo-tendinosa.
El diagnóstico de la tendinopatía aquilea es un proceso muy simple. Se puede realizar una anamnesis: la persona puede recordar un cambio en los niveles de actividad o técnicas de entrenamiento, con un aumento gradual de los síntomas. Inicialmente, el dolor puede que no sea incapacitante, pero con una actividad continuada, puede comenzar a afectar la capacidad de la persona para entrenar con eficacia28.
El tendón de Aquiles es el único que tiene que tolerar un estiramiento casi completo inmediatamente al levantarse desde por la mañana.
Por lo tanto, el dolor que se produce por la mañana es un síntoma distintivo de la tendinopatía de Aquiles, el grado y el tiempo de rigidez se consideran buenos indicadores de salud del tendón y recuperación de lesiones28.
Los síntomas de la tendinopatía pueden estar localizados en el propio tendón o en zonas circundante. Como el dolor normalmente se localiza en el tendón y no parece que se refiere a otras regiones, los síntomas que abarcan un área más grande son indicadores de otra fuente de dolor.
El cuestionario VISA-A (Victorian Institute of Sport Assessment-Achilles) es una escala subjetiva que cuantifica los síntomas y la disfunción en el tendón de Aquiles (Robinson et al. 2001). Esta herramienta de evaluación es muy útil para valorar los tendones de Aquiles y para evaluar el progreso de la recuperación durante la rehabilitación.
La VISA-A contiene ocho preguntas que cubren el dolor (preguntas 1-3), la función (preguntas 4-6), y la actividad (preguntas 7 y 8). De la pregunta 1 a la 7 se califican con un máximo de 10 y la pregunta 8 con un máximo de 30.
Las puntuaciones se suman para dar un total de 100. Una persona asintomática anotaría 100 (fig 1). Para la pregunta 8, los participantes deben responder sólo la parte A, B, o C. Si el participante tiene dolor al realizar deporte, él o ella automáticamente pierde al menos 10, y posiblemente 20 puntos9 (ver Anexo 1).
Otras pruebas clínicas y cuestionarios también se han utilizado para evaluar los resultados del tratamiento29.
En el examen clínico, el tendón puede parecer completamente normal, pero con mayor frecuencia se presentan cambios sutiles en el esquema, cada vez más grueso, tanto en el plano anteroposterior y transversal. El aumento del diámetro anteroposterior puede ser difícil de detectar clínicamente, pero es clásicamente en la porción media, y puede ser muy focal o más amplio en el área 28.
El dolor en la inserción se puede observar en individuos con amplio rango de dorsiflexión donde el calcáneo puede incidir en la cara anterior del tendón. El dolor en la inserción puede tener una causa sistémica y esta etiología debe ser explorada en su totalidad.
Si hablamos de un deportista de élite, se ha de realizar un examen completo incluyendo la biomecánica del pie, tobillo y pierna en la marcha y al correr, e incluyen análisis de movimiento lento. El examen en calzado deportivo y descalzo, con y sin ortesis (si se utiliza). El rango de flexión dorsal del tobillo debe ser medido, así como comparar con el lado no afectado 28.
Por último, debe hacerse una palpación del tendón y de las estructuras circundantes y del tríceps sural. Esta palpación puede guiar al examinador a la zona de tendón que tiene sutiles nódulos o aumento de volumen específico.
De todas maneras la palpación no es un signo de diagnóstico útil clínicamente porque pequeñas presiones provocan dolor en los tendones 28.
Como diagnósticos adicionales o de imagen tenemos la ecografía o ultrasonografía, las ventajas de la ecografía sobre la resonancia magnética son el bajo coste y la posibilidad de realizar un examen dinámico.
La morfología y las dimensiones del tendón se pueden evaluar con 7,5 MHz (o superior).
El tendón normal muestra líneas ecogénicas delgadas en la exploración longitudinal y focos ecogénicos puntiformes en el plano axial. El delgado paratendón aparece como un borde ligeramente más ecogénico alrededor del tendón. El tendón normal no muestra neovascularización en el Power Doppler Color, a diferencia de un tendón afectado que mostraría zonas con angiogénesis.
Se indica que las ecografías son fiables en mostrar bursitis retrocalcánea y en la delimitación de la lesión focal dentro del tendón, pero es inexacta para diferenciar rotura parcial de un área focal de tendinopatía. La desventaja de la ecografía es la dependencia del operador, como su fiabilidad parece correlacionarse con la experiencia del examinador14.
También podemos utilizar la resonancia magnética, es útil para mostrar la anatomía del tendón de Aquiles y es muy sensible a cambios patológicos dentro del tendón como resultado de lesiones por uso excesivo. En la resonancia magnética, el tendón de Aquiles normal suele ser oscuro en todas las secuencias de imágenes. En el plano sagital el tendón aparece paralelo y debajo a la inserción con el sóleo. En el plano axial, el margen anterior del tendón de Aquiles es cóncavo la mayor parte de su trayecto. Proximalmente, por encima de la inserción con el sóleo, el margen del tendón puede ser lineal o convexo. En el plano coronal, ambos lados del tendón de Aquiles son rectos y ensancha el tendón a medida que desciende distalmente14.
Diagnóstico diferencial
Una multitud de estructuras están implicadas en el diagnóstico diferencial en la región del tendón de Aquiles, pero un examen clínico bueno debe permitir un diagnóstico preciso. Un impigment posterior del tobillo y las bursitis, los síntomas del nervio sural y el dolor referido desde una región espinal son algunas de las patologías con la que podemos confundir una tendinopatía aquilea.
El dolor que no es específico y claro relacionado con la carga del tendón son indicios de estos diagnósticos más complejos que incluyan las enfermedades inflamatorias sistémicas. También una irritación del nervio ciático puede estar asociada con la ruptura del tendón de Aquiles a través de varios mecanismos posibles28.
TRATAMIENTOS DE FISIOTERAPIA
En fisioterapia las posibilidades son numerosas y su eficacia varía según los estudios realizados:
- Masaje transverso profundo: Acompañado de estiramientos, recupera la elasticidad y la movilidad del tejido aumentando la proliferación de fibroblastos. Igualmente el masaje del Tríceps Sural y su tendón buscaría la correcta movilización de todo el complejo músculo-tendón y su deslizamiento30.
- Ultrasonidos: El papel de los agentes electrofísicos en el tratamiento de la tendinopatía sigue siendo poco investigado en humanos. Se estimula la activación celular, tiene efectos positivos sobre el proceso de síntesis de colágeno, pero los resultados clínicos no suelen ser muy favorables para utilizar esta herramienta, por lo que no se suele indicar este método de tratamiento31.
- Ondas de Choque: Se les atribuyen efectos analgésicos, estimuladores del proceso de osteogénesis, regeneración de la zona de fibrocartílago, remodelación de la unión hueso-tendón y regeneración tisular. Esto se debe a un aumento de los factores de crecimiento y activación de los osteoblastos y fibroblastos que aceleran en proceso de reparación. Pero se necesitarían más estudios para verificar los resultados obtenidos32.
Además de las técnicas que podemos ofrecer en fisioterapia para las tendinopatías del tendón de Aquiles existen tratamientos conservadores e invasivos como inyecciones esclerosantes, tratamiento orales con AINEs o tratamiento con corticoides llevado a cabo por médicos:
- Férula nocturna: Ha demostrado ser una intervención eficaz para el tratamiento de la tendinopatía aquilea. Aunque ha demostrado tener mayor evidencia junto al programa de ejercicios excéntricos con una duración de 12 semanas30.
- Inyecciones Esclerosantes: Introducción mediante una inyección local de una sustancia capaz de destruir los nuevos vasos sanguíneos existentes tras un proceso de reparación, responsables de la aparición de dolor . Esta sustancia es el Polidiocanol que es un agente esclerosante30 34
- AINEs: mostraron poco o ningún efecto sobre la tendinopatía aquilea30.
Además una reciente investigación bioquímica sugiere que los fármacos antiinflamatorios no esteroideos (AINES) son apropiados para el tratamiento de la inflamación inducida por las prostaglandinas pero no para las tendinopatías.
Usando microdiálisis para estudiar las propiedades bioquímicas de los tendones afectados, Alfredson et al. examinaron a 20 pacientes con tendinopatías y función de rodilla dolorosa.
Los especialistas evaluaron los niveles de prostaglandinas en los pacientes y no diferían entre los tendones afectados y no afectados.
Por lo que la conclusión de estos estudios es que no hay ninguna inflamación inducida por las prostaglandinas dentro de estos tendones.
Además es importante recordar que ciertos AINES tienen efectos negativos en el metabolismo de las proteínas musculares. Así como inhiben a los tenocitos y reducen el flujo sanguíneo durante el ejercicio35.
- Corticoesteroides: Tienen efectos antiinflamatorios y analgésicos a corto plazo, pero inhibe la formación de colágeno y favorece las adherencias entre el tendón y tejidos circundantes36.
- Otros: Terapia Génica, Parches de Glyrceryl Trinitate, Inhibidores de los Factores de crecimiento VEGF, aplicación de Factores de crecimiento, plasma rico en plaquetas, etc36.
Hay que tener en cuenta que entre un 24-45,5% de las tendinopatías de Aquiles acaban recurriendo a la opción quirúrgica, pero es una cifra que tiende a ir bajando y el tratamiento conservador cada vez se muestra más eficaz37.
PROGRAMA DE EJERCICIOS BASADOS EN LA EVIDENCIA
Una de las modalidades que tenemos los fisioterapeutas de tratar este tipo de tendinopatía es a través del ejercicio excéntrico. Ya en 1984 Curwin y Stanish38 destacaron la importancia de los ejercicios excéntricos en el proceso de recuperación de los tendones afectados. Ellos demostraron el hecho con un simple programa de 6 semanas de duración mediante una carga progresiva del tendón.
Alfredson et al. en 199839 adaptó ese programa y diseñó científicamente un programa de entrenamiento excéntrico para la porción media del tendón de Aquiles.
El programa se basa en dos series (una con la rodilla en extensión y otra con la rodilla en extensión) de 3x15 repeticiones, en total 180 repeticiones al día durante 12 semanas.
El ejercicio se realiza con apoyo monopodal sobre el tendón afectado aún siendo una tendinpatía bilateral, evitando la contracción concéntrica del tendón y aumentando progresivamente la carga a medida que el paciente presentara mejora en los síntomas clínicos pudiéndose poner una mochila a la espalda cargada con peso o con máquinas de musculación.
El porqué de la posición de la rodilla está justificado, involucrando más al soleo mientras realizamos el ejercicio excéntrico con la rodilla en flexión e involucrando más los grastrocnemios con la rodilla en extensión durante la contracción excéntrica40.
El modelo de entrenamiento excéntrico de Alfredson y cols.39 no implica en ningún momento una contracción concéntrica del tendón afectado y hace especial hincapié en la necesidad del paciente en realizar el ejercicio aunque tenga alguna molestia, siempre y cuando permita esa molestia realizar el ejercicio correctamente. Si los pacientes no experimentan ningún dolor o molestia durante la realización del ejercicio pueden aumentar la carga mediante una mochila con peso o con máquinas de musculación. El programa consistía en un entrenamiento diario durante 12 semanas y obtuvo buenos resultados a corto y largo plazo. Fue eficaz cuando otros tratamientos convencionales como AINEs, reposo, el cambio de zapatos, ortesis y otras terapias físicas habían fallado, mientras que este programa de ejercicios tuvo un éxito del 90% entre los pacientes que habían sido sometidos al estudio39.
Un estudio de seguimiento realizado por los mismos autores, alrededor de unos 4 años más tarde, de los pacientes tratados con el entrenamiento excéntrico indicaba que todos estaban satisfechos y que volvieron a su actividad diaria y física sin ningún tipo de molestia. Como dato relevante en este estudio se vio que el espesor del tendón había disminuido y mediante ecografía la estructura del tendón era más normal41.
Años más tarde, Jonsson et al. en 200842 propusieron un nuevo programa de entrenamiento excéntrico, en este caso para la tendinopatía aquilea en la inserción. Se realizó un estudio a pacientes y se observó que la mayoría de pacientes tenía este tipo de tendinopatía aquilea por lo que modificaron una parte de la trayectoria a realizar en los ejercicios. Determinaron que sería mejor que los pacientes realizaran el entrenamiento excéntrico sin carga en flexión dorsal para evitar el impigment entre el tendón, bursa y hueso. De este modo la posición de partida es en flexión plantar y acto seguido realizar una contracción excéntrica hasta el suelo, sin llegar a la flexión dorsal del tobillo42.
Además un estudio realizado por Mafi et al.43 escogió a pacientes con tendinopatia aquilea crónica a nivel de 2-6 cm en el tendón. Los tratamientos fueron asignados al azar, con un excéntrico o un régimen de entrenamiento concéntrico. El estudio incluyó a 44 pacientes, con 22 pacientes (12 hombres, 10 mujeres, edad media 48 años) en cada grupo de tratamiento. La cantidad de dolor durante la actividad (correr o caminar) fue registrado por los pacientes en una escala visual analógica, y la satisfacción del paciente se evaluó antes y después del tratamiento. Los pacientes fueron instruidos para llevar a cabo su régimen de entrenamiento excéntrico o concéntrico sobre una base diaria durante 12 semanas. En ambos tipos de régimen de tratamiento a los pacientes se les dijo que tenían que hacer sus ejercicios a pesar de experimentar dolor o molestias en el tendón durante el ejercicio. Los resultados mostraron que después del régimen de entrenamiento excéntrico un 82% de los pacientes (18/22) se mostraron satisfechos y habían reanudado su nivel de actividad previo (antes de la lesión), en comparación del 36% de los pacientes (8/22) que fueron tratados con el régimen de entrenamiento concéntrico. Los resultados después del tratamiento con el entrenamiento excéntrico fue significativamente mejor (P <0,002) que después de la formación concéntrica43.
Otro estudio, en este caso un ensayo clínico randomizado44 en el que se compara diferentes métodos de tratamiento de la tendinopatía aquilea.
El objetivo fue comparar la eficacia de diferentes métodos de tratamiento: Grupo 1: Entrenamiento excéntrico. Grupo 2: Ondas de Choque y Grupo 3: Reposo
Setenta y cinco pacientes con tendinopatía aquilea crónica (más de 6 meses) fueron incluidos en este ensayo clínico. Todos los pacientes habían recibido tratamiento durante más de 3 meses, incluyendo por lo menos inyecciones locales de corticoides, AINES y fisioterapia.
Los resultados a los 4 meses desde el inicio todos los tratamientos demostraron una mayor puntuación en la VISA-A, desde 51 hasta 76 puntos en el grupo 1, de 50 a 70 puntos en el grupo 2, y 48 a 55 puntos en el grupo 3. El dolor disminuyó en todos los grupos, de 7 a 4 puntos en el grupo 1, 7 a 4 puntos del grupo 2, y de 8 a 6 puntos en el grupo 3. 15 de los 25 pacientes en grupo 1 (60%), 13 de 25 pacientes en el grupo 2 (52%), y 6 de 25 pacientes en el Grupo 3 (24%). Por tanto tras un seguimiento de 4 meses, la propuesta de tratamiento con ejercicios excéntricos en este ensayo clínico dio relativamente mejores resultados frente a las otras dos propuestas44.
Se sabe de la efectividad de los ejercicios excéntricos a corto plazo (menor de 3 años) pero recientemente se ha realizado un ensayo clínico controlado45 que realiza un seguimiento de 5 años a pacientes con tendinopatía aquilea en la porción media del tendón mediante el programa de ejercicios descrito por Alfredson. Se controlaron 58 pacientes (70 tendones). Al inicio del estudio se registraron datos como la puntuación del VISA-A, el estado del dolor, los tratamientos alternativos recibidos y anotar la neovascularización del tendón mediante Color Power Doppler. Los resultados fueron positivos registrando en 46 pacientes (58 tendones) un aumento del VISA-A de 49,2 a 83,5, el 39,7% de los pacientes fueron capaces de realizar el programa de ejercicios excéntricos sin dolor pero un 48,3% había recibido uno o más tratamientos alternativos. El espesor del tendón disminuyó de 8,05 mm a 7,50 mm a los 5 años de seguimiento45.
Además de estos ensayos clínicos randomizados, la evidencia de los ejercicios excéntricos se ha demostrado en diferentes revisiones sistemáticas. En éstas se puede ver como los excéntricos son el tratamiento hoy en día de primera opción frente a las ondas de choque, laser, ejercicios concéntricos, estiramientos, además de otros tratamientos invasivos como la inyección de corticoides o inyecciones esclerosantes. En estas revisiones sistemáticas46-49 se observa que la conclusión a la que llegan todos los autores es que los ejercicios excéntricos ofrecen buenos resultados clínicos en los pacientes, pero se desconocen todavía los mecanismos de acción que provocan la disminución del dolor, de la ausencia post-ejercicios de neovascularización o disminución del volumen del tendón46-49.
En base a toda esta recogida de datos, el programa de ejercicios terapéuticos basados en la evidencia ha sido diseñado para la tendinopatía aquilea ya sea en la porción media o inserción con el calcáneo. Esté método de tratamiento no requiere coste alguno, únicamente la disposición voluntaria del paciente para realizar los ejercicios de manera diaria. Teniendo este protocolo de ejercicios diarios como primera opción al tratamiento de las tendinopatías aquileas se podrían ahorrar el uso de tratamientos orales con AINES o inyecciones locales de corticoesteroides31.
Antes de realizar la propuesta de tratamiento para cualquier paciente debemos pedir que nos rellene el cuestionario VISA-A para poder evaluar el estado en el que se encuentra previo a los ejercicios y una vez finalizado el tratamiento.
Programa de ejercicios
El paciente colocará la punta del pie en el borde de un escalón o banco de manera que con el miembro no afectado se asista la flexión plantar del tobillo. De esta forma conseguimos que el tendón del miembro afectado no realice una contracción concéntrica, centrándonos así en la contracción excéntrica. Cuando el miembro afectado esté en flexión plantar deberá bajar lentamente el talón hacia el suelo, controlando esta bajada realizamos la contracción excéntrica del tendón de Aquiles. La finalización del ejercicio concluye cuando el tobillo ha llegado a una posición de flexión dorsal con la rodilla en extensión o en flexión en el caso de los tendones afectados en su porción media.
Si el paciente acude con una tendinopatía en la inserción del tendón se realizarán las mismas repeticiones y duración de los ejercicios pero sin llegar a esa flexión dorsal del tobillo evitando el impigment entre el tendón, bursa y hueso.
El paciente podrá realizar los ejercicios con si tiene alguna molestia, siempre y cuando le permita ejecutar los ejercicios correctamente. Además a medida que el paciente vaya notando mejoría en los síntomas clínicos podremos incorporar peso (ya sea con una mochila, mancuernas en las manos o máquinas de musculación específica para tríceps sural) para ofrecer mayor dificultad al ejercicio.
|
Series y repeticiones |
Sesiones y Duración |
||||||
|
|
||||||
|
|||||||
CONCLUSIONES
Las tendinopatías y en concreto la del tendón de Aquiles es una patología todavía en la que queda mucho por avanzar e investigar. Se sabe parte de la fisiopatología por la que se produce este tipo de tendinopatía pero aún se desconocen muchos de estos mecanismos. Desorganización de la matriz, del colágeno, presencia de sustancias moduladoras del dolor o neuropéptidos (Sustancia P, glutamato, catecolaminas, acetilcolina), neovascularización o alteración a nivel estructural de los tenocitos son los hallazgos más significativos que se pueden observar en este tipo de patología. Si parece que la mayoría coinciden en que se produce por un exceso de carga del tendón iniciando un proceso degenerativo asociado a cambios histopatológicos.
A nivel diagnóstico la ecografía o ultrasonografía ofrece una buena imagen para ver el estado del tendón y así poder verificar los síntomas clínicos que presenta el paciente. Para el diagnóstico de la tendinopatía aquilea es preciso obtener una concordancia entre los síntomas clínicos del paciente y los hallazgos de imagen que presente su tendón, es decir, hay que hacer un razonamiento clínico.
Muchos estudios avalan la eficacia de los ejercicios excéntricos en el tratamiento de la tendinopatía aquilea, siendo la medida terapéutica más eficaz frente a otros tratamientos como masaje transverso profundo, ultrasonidos, laser, ondas de choque, inyecciones esclerosantes, corticoides o AINES. Estos últimos además se ha demostrado que solo actúan a nivel de inflamación mediada por prostaglandinas y no en procesos como la tendinopatía, inhibiendo también la síntesis de colágeno.
Este tipo de ejercicios actúan incrementando la síntesis de colágeno en mayor medida que los concéntricos, reduce la presencia de capilares dentro del tendón y degrada en menor medida la matriz extracelular. En definitiva, aunque la realización de los ejercicios excéntricos en este tipo de patología presenten mejoras en los signos y síntomas del paciente se necesitan mucha más investigación y estudios para determinar los mecanismos de acción que provocan esta mejora en los pacientes.
BIBLIOGRAFÍA
- Alfredson H, Lorentzon R. Chronic tendon pain: no signs of chemical inflammation but high concentrations of the neurotransmitter glutamate. Implications for treatment? Curr Drug Targets 2002; 3: 43–54.
- Maffulli N, Khan KM. Puddu G. Overuse tendon conditions: time to change a confusing terminology. Arthroscopy. 1998; 14:840-43.
- Cook J, Purdam C. Is tendon pathology a continuum? A pathology model to explain the clinical presentation of load-induced tendinopathy. Br J Sports Med 2009;43:409–416
- Sharma P, Maffulli N. Biology of tendon injury: healing, modeling and remodeling. J Musculoskelet Neuronal Interact 2006; 6: 181–90.
- Alfredson H, Ohberg L, Forsgren S. Is vasculo-neural ingrowth the cause of pain in chronic Achilles tendinosis? An investigation using ultrasonography and colour Doppler, immunohistochemistry, and diagnostic injections. Knee Surg Sports Traumatol Arthrosc 2003; 11: 334–38.
- Kujala UM, Sarna S, Kaprio J. Cumulative incidence of Achilles tendon rupture and tendinopathy in male former elite athletes. Clin J Sport Med 2005; 15: 133–35.
- Lian O, Engebretsen L, Bahr R. Prevalence of jumper’s knee among elite athletes from different sports: a cross-sectional study. Am J Sports Med 2005; 33: 561–67.
- van Dijk CN, van Sterkenburg MN, Wiegerinck JI, Karlsson J, Maffulli N. Terminology for Achilles tendon related disorders. Knee Surg Sports Traumatol Arthrosc 2011; 19:835–41
- Robinson JM, Cook J, Purdam C, Visentini P, Ross J, Maffulli N, et al. The VISA-A questionnaire: a valid and reliable index of the clinical severity of Achilles tendinopathy. Br J Sports Med 2001;35:335–41
- Maffulli N, Kenward MG, Testa V, Capasso G, Regine R, King JB. Clinical diagnosis of Achilles tendinopathy with tendinosis. Clin J Sport Med 2003; 13: 11–15.
- Bleakney RR, White LM. Imaging of the Achilles tendon. Foot Ankle Clin 2005; 10: 239-54.
- Newman JS, Adler RS, Bude RO, Rubin JM. Detection of soft-tissue hyperemia: value of power Doppler sonography. AJR Am J Roentgenol 1994; 163(2): 385-9.
- Doral MN, Alam M, Bozkurt M, Turhan E, Atay OA, Dönmez G. Functional anatomy of the Achilles tendon. Knee Surg Sports Traumatol Arthrosc 2010; 18:638–43
- Pierre-Jerome C, Moncayo V, Terk MR. MRI of the Achilles tendon: a comprehensive review of the anatomy, biomechanics, and imaging of overuse tendinopathies. Acta Radiol. 2010; 51(4):438-54.
- Kannus P. Etiology and pathophysiology of chronic tendon disorders in sports. Scand J Med Sci Sports 1997; 7: 78-85.
- Fredberg U, Stengaard-Pedersen K. Chronic tendinopathy tissue pathology, pain mechanisms, and etiology with a special focus on inflammation. Scand J Med Sci Sports 2008: 18: 3–15
- Xu Y, Murrell GA .The Basic Science of Tendinopathy. Clin Orthop Relat Res 2008; 466:1528–38.
- Andersson G, Backman LJ, Scott A, Lorentzon R, Forsgren S, Danielson P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis inresponse to Achilles tendon overuse in a tendinopathy model. Br J Sports Med 2011; 45: 1017–22.
- Backman LJ, Fong G, Andersson G, Scott A, Danielson P. Substance P Is a Mechanoresponsive, Autocrine Regulator of Human Tenocyte Proliferation. PLoS ONE 2011; 6 (11): e27209.
- Backman LJ, Andersson G, Wennstig G, Forsgren S, Danielson P. Endogenous substance P production in the Achilles tendon increases with loading in an in vivo model oftendinopathy-peptidergic elevation preceding tendinosis-like tissue changes. J Musculoskelet Neuronal Interact 2011; 11(2):133-40.
- Alfredson H, Lorentzon R. Intratendinous glutamate levels and eccentric training in chronic Achilles tendinosis: a prospective study using microdialysis tecnique. KNEE Surg Sports Traumatol Arthrosc 2003; 11: 196-99.
- van Sterkenburg MN, van Dijk CN. Mid-portion Achilles tendinopathy: why painful? An evidence-based philosophy. Knee Surg Sports Traumatol Arthrosc 2011;19:1367–75.
- Knobloch K. The role of tendon microcirculation in Achilles and patellar Tendinopathy. Journal of Orthopaedic Surgery and Research 2008; 3:18.
- Pingel J, Fredberg U, Qvortrup K, Larsen JO, Schjerling P, Heinemeier K, et al. Local biochemical and morphological differences in human Achilles tendinopathy: a case control study. BMC Musculoskelet Disord. 2012; 5:13:53.
- Heinemeier KM, Olesen JL, Haddad F, Langberg H, Kjaer M, Baldwin KM, et al. Expression of collagen and related growth factors in rat tendon and skeletal muscle in response to specific contraction types. J Physiol 2007; 582:1303–16.
- Kjær M, Langberg H, Heinemeier KM, Bayer ML, Hansen M, Holm L, et al. From mechanical loading to collagen synthesis, structural changes and function in human tendon. Scand J Med Sci Sports 2009; 19: 500–10.
- Ohberg L, Alfredson H. Effects on neovascularisation behind the good results with eccentric training in chronic mid-portion Achilles tendinosis? Knee Surg Sports Traumatol Arthrosc 2004; 12 : 465–70.
- Cook J, Khan KM, Purdam C. Achilles tendinopathy. Manual Therapy 2002; 7(3): 121–30.
- Silbernagel KG, Thomeé R, Thomeé P, Karlsson J. Eccentric overload training for patients with chronic Achilles tendon pain—a randomised controlled study with reliability testing of the evaluation methods. Scand J Med Sci Sports. 2001; 11(4):197-206.
- Alfredson H, Cook J. A treatment algorithm for managing Achilles tendinopathy: new treatment options. Br J Sports Med 2007; 41: 211-16.
- Fu S, Shum W, Hung L, Wong M, Qin L, Chan K. Low-intensity pulsed ultrasound on tendon healing: A study of effect of treatment duration and treatment initiation. Am J Sports Med. 2008;36; 1742-49.
- Furia J.P. High-energy extracorporeal shock wave therapy as a treatment for chronic noninsertional Achilles tendinopathy. Am J Sports Med 2008; 36: 502-8.
- Roos E, Engstrom M, Lagerquist A, et al. Clinical improvement after 6 weeks of eccentric exercise in patients with mid-portion Achilles tendinopathy: a randomized trial with 1-year follow-up. Scand J Med Sci Sports 2004;14:286–95.
- Alfredson H, Öhberg L. Neovascularisation in chronic painful patellar tendinosis – promising results after sclerosing neovessels outside the tendon challenge the need for surgery. Knee Surg Sports Traumatol Arthrosc 2005; 13: 74-80.
- Alfredson H, Dimmen S. Non-steriodal anti-inflammatory drugs and tissue healing. Mini symposium. En: 12th ESSKA Congress y 5th World Congress on Sports Trauma. Innsbruck May 24-27, 2006.
- Andres B, Murrell G. Treatment of Tendonopathy. Clin Orthop Relat Res. 2008; 466: 1539-54.
- Maffulli N, Sharma P, luscombe K. Achilles tendinopathy: Aetiology and management. J of the Royal Societty of Med. 2004; 97(10):472-76.
- Curwin S, Stanish WD. Tendinitis: its etiology and treatment. Lexington: Collamore Press, 1984.
- Alfredson H, Pietila T, Jonsson P, Lorentzon R. Heavy-load eccentric calf muscle training for the treatment of chronic Achilles tendinosis. Am J Sports Med 1998; 26:360-6.
- Reid D, McNair PJ, Johnson S, Potts G, Witvrouw E, Mahieu N. Electromyographic analysis of an eccentric calf muscle exercise in persons with and without Achillestendinopathy. Phys Ther Sport 2012; 13:150-5.
- Öhberg L, Lorentzon R, Alfredson H. Eccentric training in patients with chronic Achilles tendinosis: normalised tendon structure and decreased thickness at follow up. Br J Sports Med 2004; 38:8–11.
- Jonsson P, Alfredson H, Sunding K, Fahlström M, Cook J.New regimen for eccentric calf-muscle training in patients with chronic insertional Achilles tendinopathy: results of a pilot study Br J Sports Med 2008;42:746–749.
- Mafi N, Lorentzon R ,Alfredson H. Superior short-term results with eccentric calf muscle training compared to concentric training in a randomized prospective multicenter study on patients with chronic Achilles tendinosis. Knee Surg Sports Traumatol Arthrosc 2001; 9: 42-7.
- Rompe JD, Nafe B, Furia JP, Maffulli N: Eccentric loading, shock-wave treatment, or a wait-and-see policy for tendinopathy of the main body of tendo Achillis: a randomized controlled trial. Am J Sports Med 2007; 35:374–83.
- van der Plas A, de Jonge S, de Vos RJ, van der Heide HJ, Verhaar JA, Weir A, et al. A 5 year follow-up study of Alfredson’s heel drop exercise programme in chronic midportion Achilles tendinopathy. Br J Sports Med 2012; 46:214-18.
- Sussmilch-Leitch SP, Collins NJ, Bialocerkowski AE, Warden SJ, Crossley KM. Physical therapies for Achilles tendinopathy: systematic review and meta-analysis. Journal of Foot and Ankle Research 2012; 5:15.
- Magnussen RA, Dunn WR, Thomson AB. Nonoperative treatment of midportion Achilles tendinopathy: a systematic review. Clin J Sport Med 2009;19:54–64
- Kingma J, de Knikker R, Wittink H, Takken T. Eccentric overload training in patients with chronic Achilles tendinopathy: a systematic review. Br J Sports Med 2007;41:6
- Satyendra L, Byl N. Effectiveness of physical therapy for Achilles tendinopathy: an evidence based review of eccentric exercises. Isokinetics and Exercise Science 2006; 14(1): 71-80.



