Nuria Carreras Regorigo.
Fisioterapeuta diplomada en la Universidad de Valladolid.
INTRODUCCIÓN.
-Concepto ELA:
Según el NINDS (Instituto Nacional de Trastornos Neurológicos y Accidentes Neurovasculares) la Esclerosis Lateral Amiotrófica (ELA), también llamada Enfermedad de Charcot o de Lou Gehrig y conocida comúnmente como Enfermedad de Motoneurona, es una patología neurológica progresiva, invariablemente fatal, que ataca a las células nerviosas encargadas de controlar los músculos voluntarios.
Descrita por primera vez por Jean-Martin Charcot en el año de 1869(1), se caracteriza porque las neuronas motoras relacionadas con los movimientos oculares y los músculos esfinterianos, así como de la sensibilidad superficial y profunda, el sistema sensorial, el estado de conciencia y el funcionamiento del músculo liso, no se ven alterados, mientras sí lo están los músculos respiratorios, los encargados de la deglución y el músculo estriado del Sistema Musculoesquelético.(2)
Se trata de una enfermedad de etiología multifactorial y sistémica cuya incidencia aproximada varía de 0,3 a 2.5 casos por año y por cada 100.000 habitantes.(2), con una supervivencia media de 3 años en el 50% de los casos, de 5 en el 20% y de 10 o más años en el 5%(.2).
Las manifestaciones clínicas de la ELA se reúnen en: compromiso específico del Sistema Motor, asociación en un mismo territorio de síntomas y signos de afectación de motoneurona superior e inferior e inicio localizado y progresión de la parálisis.(3) . Profundizando un poco más, los signos y síntomas específicos de motoneurona inferior (espinal o bulbar) son: debilidad y atrofia muscular, fasciculaciones, calambres musculares, hipotonía y arreflexia; y los signos de motoneurona superior o cortical: debilidad muscular, espasticidad, hiperreflexia, aparición de reflejos patológicos (signo de Babinski, clonus rotuliano, aquíleo..) y labilidad emocional (2).
-Clasificación:
Por su etiología, se clasifica la E.L.A en dos tipos :
-Genética o Familiar: Tiene cierto componente hereditario: Un 5-10% de los casos de ELA tienen carácter familiar y entre estos, un 15-20% son debidos a una mutación autosómica dominante en el cromosoma 21, el gen que codifica la SOD-1 Cu-Zn (Superóxido Dismutasa). Otros genes implicados son el gen FUS, el gen TARDB y el gen C9ORF72. Actualmente, las mutaciones del gen C9ORF72,son las alteraciones más frecuentes en la ELA familiar y, junto con el gen TARDP, son los predominantemente asociados a formas de ELA relacionadas con enfermedades como la demencia frontotemporal.(3)
-Esporádica: Es la más frecuente y su origen idiopático o desconocido. Algunas hipótesis que explicarían su aparición son el extrés oxidativo y el aumento de radicales libres, la alteración del transporte axónico,…etc. que se describirán posteriormente. La mutación en el gen de la SOD, también conforma el 3% de los casos de ELA esporádica.(3)
-Diagnóstico:
Por su comienzo insidioso de pérdida de fuerza muscular sin causa aparente, la presentación de disnea desencadenada por esfuerzos mínimos al afectarse el diafragma, o por los falsos negativos ante la existencia de hallazgos neurológicos que no justifican la enfermedad, resulta complicado realizar un correcto diagnóstico temprano (4). En el año 1990, la Federación Mundial de Neurología estableció los criterios diagnósticos conocidos como El Escorial (5), que atienden a las regiones afectadas y a las manifestaciones clínicas detectadas y su naturaleza. (Ver Tabla A). Dichos criterios permanecieron vigentes tras su revisión en 1998, momento en el que se establecieron los criterios de Arlie, en los que, al juicio clínico, se añadieron pruebas de laboratorio (electromiografía, neuroimagen…).(6) Desde el año 2006, también se han incluído los Criterios d´Awaji. Estos se centran en la importancia de los estudios electromiográficos como fuente que proporciona datos correlacionados con la clínica, así como de la presencia de fasciculaciones como factor concluyente de Enfermedad de Motoneurona.(7)
También es importante efectuar un correcto diagnóstico electrofisiológico. (8,9,10,11,12,13,14,15,16), que incluiría primordialmente el análisis de las velocidades de conducción, en las que el cambio más significativo es la reducción de la amplitud del potencial de acción compuesto motor, y la electromiografía(13).Es relevante tener presente que los cambios que contribuyen a la hiperreflexia son la hiperexcitabilidad de las motoneuronas α, modificaciones en sus propiedades intrínsecas y un menor tiempo post-activación en los mecanismos de transmisión de las fibras Ia, entre otros.(8,9,10).Como método para evaluar la hiperreflexia, se utiliza el reflejo H o reflejo de Hoffman, equivalente al reflejo miotático, que se compone de una respuesta electromiográfica promovida por la activación sináptica de las motoneuronas, mediante aferencias a los músculos, seguido de la estimulación de la placa motora.(8,9,10,11,12,14,15).Su ventaja esencial es que es un reflejo muy sensitivo cuya amplitud es el resultado de una serie de mecanismos neuronales complejos, que actúan sincrónicamente.(15). La exploración también contempla la Onda F, que es la respuesta tardía obtenida por una estimulación supramáxima de los nervios periféricos motores y mixtos(16).
Aparte de estos métodos diagnósticos, también figuran el estudio neurorradiológico de la enfermedad, el estudio genético y el diagnóstico diferencial respecto a otras enfermedades similares, en los que no se profundiza en el presente trabajo(6).
| CRITERIOS DE El Escorial | |||
|
El diagnóstico de ELA requiere: |
Categorías de ELA |
Deben estar ausentes: |
El diagnóstico de ELA |
|
1. Signos de MNS. 2. Signos de MNI. 3.Curso progresivo |
-Definida: MNS+MNI en tres regiones. -Probable: MNS+MNI en dos regiones (MNS rostral a MNI) -Posible: MNS+MNI en una región; MNS en dos o tres regiones (ELP) -Sospecha: MNI en dos o tres regiones (AMP) |
autonómico.
|
-Fasciculaciones en una o más regiones. -EMG con cambios neurogénicos. -Velocidad de conducción motora y sensitiva normales (latencias distales pueden ser aumentadas). -Ausencia de bloqueos de conducción. |
Tabla A: Criterios Diagnósticos de ELA. El Escorial. *Regiones: Bulbar, cervical, torácica y lumbo-sacra.
MNI: Neurona Motora Inferior. MNS: Neurona Motora superior. AMP: Atrofia Muscular Progresiva
ELP: Esclerosis lateral primaria.
-Etiopatogenia:
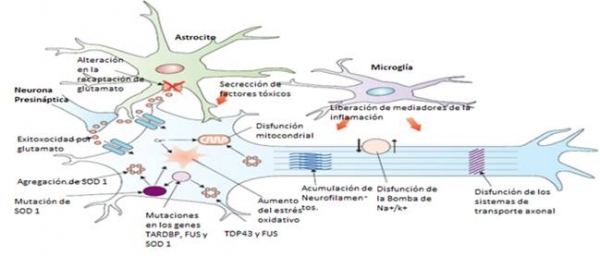
Los mecanismos etiopatogénicos subyacentes al desarrollo de la ELA, en sus dos variantes, parecen ser multifactoriales, con una creciente evidencia de una compleja interacción entre vías moleculares y genéticas.(1,4) Entre ellos se incluyen la excitoxicidad inducida por glutamato, el estrés oxidativo, la agregación proteica(17), disfunciones mitocondriales, insuficiente liberación de factores neurotróficos, activación de procesos pro-apoptóticos, mutaciones FUS en el cromosoma 16, defectos en la respuesta inmunológica, alteraciones de la función Prion-like, degeneración por parte de astrocitos y microglía, y disrupciones de los procesos de transporte axonal anterógrado y retrógrado y/o de la estructura de los neurofilamentos(1,3,4).
A continuación se expondrán de manera sucinta los más destacables:(1,2,4)
-Mutaciones en el gen de la SOD 1-Cu-Zn: Este enzima es un poderoso antioxidante que protege al cuerpo del daño causado por los radicales libres, de manera que, si aumenta el depósito intraneuronal del enzima mutado, pueden acumularse y causar daños aleatorios al ADN y a las proteínas celulares.
-Excitotoxicidad inducida por glutamato: El glutamato, principal neurotransmisor excitatorio del SNC, se une a los receptores NMDA y AMPA en la membrana postsináptica. Su excitoxicidad inducida por la activación excesiva de éstos, puede incitar a la neurodegeneración a través de la activación de las vías enzimáticas dependientes del calcio y a la producción de radicales libres, que, a su vez, mediante un sistema de retroalimentación positiva, causen daño en los órganos intracelulares y activen los mediadores de la inflamación.(3)
-Degeneración por parte de astrocitos y microglía: Las células nerviosas no neuronales, también pueden colaborar en la degradación a través de mecanismos que incluyen la insuficiente liberación de factores neurotróficos, y la secreción de mediadores de neurotoxinas, así como la aparición de marcadores de la inflamación como la caspasa 1 y el TNF, entre otros.(4)
-Disfunción mitocondrial: Su origen es la deficiente formación de ATP en la célula con alta carga metabólica, y como consecuencia, una disfunción de la bomba Na+/K+ y aparición de acúmulos intramitocondriales de la SOD dañada y mutada.(4)
-El gen TAR-DBP (TDP 43) y FUS: Aunque parece ser que ambos mantienen una vía diferente de actuación, son proteínas multifuncionales involucradas en la transcripción, ensamblaje, transporte y translación del ADN , y en el procesamiento de MicroARNs. Las mutaciones de la TDP 43 constituyen el 5-10% de los casos de ELA familiar y hasta el 5% de ELA esporádica. La TDP 43, fue reconocida como un componente primordial de los agregados de proteínas ubiquitinadas citoplasmáticas, porque enlaza tanto al ADN como al ARN,lo que podría resolverse en una desregulación del procesamiento de éste último.(4)
-El gen C9ORF72: Provoca el 24-46% de los casos de ELA familiar y el 4-21% de los casos de ELA esporádica. Es el responsable de la alteración del mecanismo del ARN y de la aparición de inclusiones proteicas mal plegadas.(4)
-Mutaciones en los dominios Prion-like en hnRNPA2B1 y en hnRNPA1: Se consideran las causantes de la aparición de proteinopatías multisistémicas y del desarrollo de la ELA. El dominio Prion-like es esencial para el ensamblaje de los gránulos de ribonucleoproteínas, y se han localizado alteraciones causantes del inicio y propagación de la Enfermedad de las Motoneuronas por un defecto de la autofagia.(4)
Imagen 1. Resumen de los Mecanismos Etipatogénicos de la ELA. Adaptación de la imagen de Grosskreutz J(6)

-Abordaje terapéutico:
Hasta el momento, las investigaciones están encaminadas a conseguir la inhibición de su progresión y a paliar las afectaciones del paciente.(2,3) En cuanto al tratamiento de la ELA, debe ser integral, temprano y multidisciplinar(18)(19),ya que engloba terapias que contemplan los problemas respiratorios, de deglución (disfagia, sialorrea…), el estado anímico, y el resto de la sintomatología que acompaña a dicha patología, y aunque aún no haya ninguno concluyente, los tratamientos etiopatogénicos, con fármacos que la ralentizan, son los más eficientes. (2,3,20). Algunos ejemplos de ello son:
-Inhibición de la excitotoxicidad: El fármaco más utilizado es el Riluzole (21), el único que ha demostrado cierta eficacia en su estabilización al actuar sobre los receptores de glutamato y, secundariamente, como tratamiento neutralizante de los radicales libres. Otros antiglutamatérgicos empleados son la Gabapentina(22), que bloquea la biosíntesis de glutamato, y el Topiramato(23), que aunque teóricamente podrían ser beneficiosos, su efecto no ha sido confimado en ensayos clínicos aleatorizados y a doble ciego.
-Suministro de agentes protectores del sistema nervioso y de la degeneración neuronal: como el IGF-1(24), la Creatina(25) y el Litio(26).
-Tratamiento con agentes antinflamatorios como el Celecobix y la Minociclina(27).
Además, en distintas fases de ensayo clínico se encuentran las siguientes terapias emergentes:(2,3,28)
-Transplante autólogo de células madre (stem cell).
-Transferencia de genes mediante vectores víricos para aportar moléculas neuroprotectoras, factores neurotróficos, genes antiapoptóticos,…
-Estimulación de genes mediante la CDDOs de los “genes fase II ” con actividad antioxidante, antiinflamatoria y de los enzimas mitocondriales.
-Inhibición de genes mediante el enzima productor de la D-serina, coagonista del receptor NMDA.
Dado el enfoque planteado en este estudio, el tratamiento en el que más se ahondará será el rehabilitador, y, dentro de él, en sus aspectos fisioterapéuticos. Desgraciadamente la fisioterapia no se ha mostrado como una herramienta eficaz en estadios avanzados de ELA, pero si se consiguiera realizar un diagnóstico precoz y pudiera aplicarse de manera temprana, es posible que mejorara la calidad de vida del paciente porque aumentaría su fuerza y contracción muscular (29,30,31,32,33,34). Sin duda, el mayor problema que existe en esta patología cuando se administra cualquier terapia, es que la degeneración y el pronóstico fatal de la misma avanzan mucho más rápidamente que la acción de los tratamientos, lo que unido al bajo estado anímico, dificulta la obtención de resultados destacables. A ello se suma que, las características de esta enfermedad, hacen que el Sistema Sanitario Público no ofrezca una rehabilitación continuada a estos pacientes, que durante la realización de este estudio, a pesar de todo, han respondido con gran interés y gratitud.
Por último, poner de relieve que tal y como dispone la Ley 14/2007, de 3 de julio de Investigación Biomédica, el presente trabajo se adecúa a la normativa de investigación en humanos.
2. PLANTEAMIENTOS Y OBJETIVOS.
La hipótesis de esta investigación es la determinación de los beneficios conseguidos durante un plazo de tres meses en la aplicación de diversos métodos fisioterapéuticos, como tratamiento de las diversas alteraciones acontecidas en un grupo de pacientes de ELA(29,30,3132,33,34) .El objetivo principal es la aplicación del método fisioterapéutico Vojta y la observación de la respuesta al mismo atendiendo a diversos parámetros, comparándolo con el grupo control al que se le aplican exclusivamente procedimientos de fisioterapia convencional. En segundo lugar, la confrontación pre y postratamiento de los resultados de cada terapia, con el fin de concretar los posibles efectos que éstas producen a nivel musculoesquelético en la Enfermedad de Motoneurona.
-Objetivos Terapia Vojta:
Con el Método Vojta se pretende conseguir:
1. Control automático de la postura y mejora de la función de apoyo de las extremidades, así como la facilitación de una actividad muscular coordinada.
2. Recuperación o mantenimiento de patrones de movimiento fisiológicos.
3. Conservación de una locomoción bípeda con o sin ayudas técnicas (andador, bastón…).
4. Re-direccionamiento del centro de gravedad, lo que facilita la motricidad del individuo.
5. Activación o mantenimiento de la musculatura mímica, mecanismo de deglución, movimientos oculares, respiración y funciones vesical y rectal.
Los objetivos que se persiguen en la aplicación de técnicas específicas de fisioterapia son:
- Corrección de las alteraciones posturales.
- Prevención del dolor músculo-esquelético y mejora de la debilidad muscular.
- Conservación de la contracción muscular y rango de movimiento articular.
- Disminución de la rigidez y mitigación de la hipotonía y/o espasticidad.
- Promoción de la independencia funcional y aumento de la tolerancia al ejercicio físico.
- Disminución de las caídas y golpes mediante la conservación del equilibrio estático y dinámico y reeducación de la marcha en aquéllos que la tienen alterada.
3. MATERIAL Y MÉTODOS.
El presente trabajo es un estudio piloto, a ciego simple (el médico examinador desconocía a qué grupo pertenecía cada paciente), en el que participaron 8 enfermos de ELA, con una edad media de 56,44 años, pacientes del Servicio de Neurología del Hospital Clínico Universitario de Salamanca, que fueron repartidos en dos grupos en la misma proporción: el grupo de terapia Vojta y el grupo control, al que se le realizó una tabla de ejercicios de fisioterapia dirigida principalmente al mantenimiento de la fuerza muscular y arco de movimiento, así como las funciones articulares encaminadas a la realización de Actividades de la Vida Diaria (AVD).
De los 20 posibles pacientes candidatos que se pretendía incluir en el proyecto en diferentes días a lo largo de tres meses, 8 de ellos habían fallecido, 2 decían encontrarse indispuestos para acudir a consulta y 2 de los 10 restantes no pudieron finalizar el estudio. Como problemas añadidos surgieron dificultades de transporte en aquéllos que no habitaban en la capital, la escasa comunicación de las ambulancias con los municipios adyacentes, el empeoramiento progresivo,…Así pues, los criterios de exclusión están marcados por lo anteriormente mencionado y por la falta de motivación de algunos pacientes. En contrapartida, los criterios de inclusión fueron amplios (el único condicionante fue la firma del consentimiento informado. Ver doc. 1), con la intención de reunir una muestra más representativa de la población de referencia.
Con el fin de analizar de manera más imparcial los resultados obtenidos con cada una de las terapias, se anotaron cuántos de los sujetos expuestos a tratamiento realizaban fisioterapia por su cuenta. De los 8 pacientes, tan sólo tres hacían terapia física a nivel particular y todos ellos fueron incluidos en el grupo control para que no pudiera influir este aspecto en la extrapolación de los resultados.
Días después de la exploración neurológica en consulta, comenzaron las terapias en la sala de fisioterapia de la Escuela Universitaria de Enfermería y Fisioterapia de Salamanca. Se anotó la fecha de exploración inicial en la consulta del Dr. D.Tomás Alburquerque y la que sería la correspondiente a la evaluación final, pasados tres meses. Se dividió (n=8), en dos grupos: el grupo control y el grupo Vojta o grupo terapia. Tras detallar a cada componente el tipo de tratamiento que iba a seguir, se le entregó al primer conjunto una tabla de ejercicios para realizar diariamente en su domicilio, y al segundo, las instrucciones a modo de guía para la aplicación diaria del método Vojta. A partir de este momento, se llevó a cabo un seguimiento rutinario e individualizado de cada paciente cada 15 días en el que se determinaba la situación de cada sujeto, sus progresos y se ajustaban los ejercicios cuando era preciso .Finalmente, pasado el tiempo estipulado y según el orden inicial, se recogieron nuevamente los registros electrofisiológicos y la valoración neurológica de cada uno de ellos.
-Valoraciones en la consulta de Neurología.
Consistieron en una exploración neurológica general a cada miembro en el que fueron anotados los reflejos patológicos, la ausencia o presencia de fasciculaciones,…etc. (Ver doc 3), un balance muscular en el que se midió de grado 0 (nulo; ausencia de contracción) a 5 (bueno; contracción normal) la fuerza muscular en los grupos claves del tronco, miembros superiores e inferiores (Ver doc.2), una Escala de Valoración Funcional en la que se calificaron las dificultades para realizar correctamente distintas actividades de la vida diaria, el grado de disnea en presencia o ausencia de actividad física,…etc, y un estudio electrofisiológico en el que se evaluaron distintos parámetros como el reflejo H, la onda F y la amplitud del potencial compuesto motor (8,9,10,16), con la finalidad de baremar el grado de espasticidad y atrofia de la musculatura afectada.(Ver doc 4). Se registró el potencial compuesto motor en los músculos abductor pollicis brevis (abductor corto del pulgar), abductor digiti quinti (abductor del meñique) y extensor digitorum brevis (extensor corto de los dedos), tras la estimulación supramáxima de los nervios mediano y cubital y el peroneo profundo a nivel del tobillo respectivamente, mediante el resgistro de la respuesta evocada por la generación de potenciales de acción. Se utilizó una intensidad de estímulo supramáxima, es decir, que excediese de un 10-25 % la intensidad con la cual el potencial evocado ya no aumentaba más, y una duración de estímulo de 0,2 milisegundos (msg) ,para despolarizar el mayor número de fibras musculares y alcanzar la máxima amplitud del potencial de acción compuesto motor hallado. Éste representa la suma de potenciales individuales de todas las fibras musculares subyacentes.(35)
Se evocó el reflejo H en el músculo sóleo colocando un electrodo referencial sobre el tendón de Aquiles, aplicando estímulos de baja intensidad y larga duración sobre el nervio tibial posterior en la fosa poplítea para estimular las fibras de grueso calibre Ia(8,9,10,11). A medida que se incrementaba la intensidad de estímulo, se logró la activación de un mayor número de éstas y el reclutamiento progresivo de unidades motoras de mayor umbral, con el consecuente aumento de la amplitud del reflejo H. Cuando la magnitud fue suficiente como para lograr la activación directa de los axones de las motoneuronas α del nervio estimulado, se observó en el registro la onda M o respuesta muscular(14) .
-Valoraciones en la Sala de Fisioterapia:

![]()
Además del análisis holístico de la postura y movimientos de cada paciente, se efectuaron fundamentalmente dos mediciones:
-Una espirometría: Para obtener valores determinantes del estado y grado de afectación de la musculatura respiratoria del paciente. Se extrajeron datos propios de la espirometría simple como el Volumen Corriente (Vc), el Volumen de Reserva Espiratoria (VRE), la Capacidad Vital (CV), el Pico Flujo Espiratorio (PEF) y el PIF (Pico Flujo Inspiratorio) ; y de la espirometría forzada como la Capacidad Vital Forzada (CVF), el FEV1 o VEMS (Volumen Espiratorio Forzado durante el primer segundo), y la relación FEV1/CVF. (Córdova, A.,2003).


-Prueba en la plataforma dinamométrica: Según las huellas registradas en el dispositivo como indicadoras de la base de apoyo, se midió el equilibrio en la estática y la marcha en la dinámica, y gracias a una electromiografía, pudo conocerse la actividad muscular durante la marcha. Este técnica consiste en el registro gráfico de la actividad eléctrica de los músculos durante la contracción o tras la estimulación de un nervio (13,35), y se realizó colocando 5 electrodos en el miembro inferior más afectado en cada caso: el electrodo referencial o tierra en la rótula, dos electrodos correspondientes al canal 1 en gastrocnemios (porción interna y externa),y otros dos pertenecientes al canal 2, en el tibial anterior. Por incapacidad para la marcha, la parte dinámica no pudo llevarse a cabo en 2 de los 8 pacientes. La valoración de la posición estática se midió en todos ellos.
Se ha evaluado cada marcha pre y post tratamiento en períodos de 10 segundos y analizado los gastrocnemios y el tibial anterior, como los dos músculos principales que intervienen en ella a lo largo de sus dos fases: apoyo (60% del tiempo de cada ciclo de la marcha) y oscilación (40% del tiempo de cada ciclo). Los gastrocnemios tienen un papel primordial en la fase final de apoyo, estabilizando la articulación del tobillo, controlando la extensión de la rodilla y favoreciendo el avance y la amplitud de los pasos(36).Por su parte el tibial anterior es trascendente al principio de la fase de apoyo y de oscilación, actuando mediante el frenado del pie sobre el suelo y realizando la función correcta de flexión dorsal para evitar la “marcha en estepaje” como consecuencia del equinismo del pie(37).
Tomando el paso como unidad básica de la marcha, se han explorado los parámetros de fuerza de paso, largo o longitud de paso, pasos por minuto o cadencia de la marcha (número de pasos realizados por unidad de tiempo) y la distancia entre pasos. En general todos estos aspectos se ven influidos por factores como la edad, el sexo, la estatura, diversas patologías, el dolor al andar(37,38),…
En la inspección de la posición estática se ha valorado la actividad muscular de gastrocnemios y tibial anterior, además del porcentaje de la superficie y carga de la base de sustentación, durante un intervalo de 10 segundos. Tal y como se especifica en el apartado de resultados, se distingue entre el examen con ojos abiertos y con ojos cerrados, pero no se han reseñado los datos obtenidos de la exploración del Signo de Romberg,(presente cuando el paciente es capaz de mantener la posición con ojos abiertos, pero oscila o se cae al cerrarlos(37)), debido a la excesiva extensión que estaba adquiriendo este trabajo.
-Grupos de terapia ELA.
Como se ha señalado, la muestra se dividió en dos grupos, el control o fisioterapia y el de terapia Vojta.
-Terapia Vojta:
La técnica Vojta o Terapia de Locomoción Refleja se remonta a los años 50 cuando el pediatra Checo Václav Vojta manipulaba a un niño en edad escolar con paraparesia espástica y observó que se modificaba su hipertonía muscular. Estudió distintos casos y elaboró una hipótesis de trabajo que le permitió seguir investigando en niños con parálisis cerebral infantil. Años más tarde, se aplicó esta terapia de manera exitosa en pacientes con esclerosis múltiple y polirradiculomielitis y comenzó a emplearse en lactantes con alteraciones motoras, lo que se convirtió posteriormente en su práctica más habitual. El punto clave de su descubrimiento fue el análisis de respuestas motoras globales ante determinados estímulos a partir de posiciones corporales concretas y visualizó que la actividad muscular dinámica que se desencadenaba con ellas,(39) era la misma que aparecía en casi todas las formas de locomoción humana, activando así, patrones normales de movimiento.(Vojta,V, Peters,A 1995).
En la actualidad no es una terapia muy utilizada, en algunos casos por desconocimiento de los profesionales en la materia. No obstante, aquéllos que lo emplean, cada vez lo aplican en fases más tempranas de muy diversas enfermedades (parálisis cerebral infantil, traumatismos craneoencefálicos, neuropatías periféricas, lesiones medulares parciales, alteraciones musculoesqueléticas,…etc.), como método preventivo o como una importante herramienta para evitar el agravio de las patologías y futuras complicaciones derivadas del transcurso de las mismas. Por sus mecanismos de actuación, se logran, entre otros beneficios, la activación de las áreas motoras cerebrales (sobre todo el Área 4 de Brodmann, influyendo así sobre el enderezamiento del cuerpo, el equilibrio y los movimientos intencionales), la activación de los patrones de locomoción refleja (estimulando los grupos musculares dependientes de las raíces nerviosas afectadas, los campos receptivos a nivel de los dermatomas e induciendo a la neuroplasticidad) y la consecución de contracciones musculares isotónicas e isométricas (aprovechando terapéuticamente esta actividad muscular provocada)(.39) (Vojta,V,Peters,A , 1995).
Como tratamiento de los sujetos encuadrados dentro del Grupo Vojta, se han introducido dos posturas básicas de este Método: la reptación refleja y el volteo reflejo, como se detalla en las imágenes que se exponen a continuación.

Son dos posturas sencillas y fáciles de reproducir por el que ejecuta el Método. En ellas se coloca el enfermo o bien en decúbito supino (volteo) o bien en decúbito prono (reptación). Haciendo presiones periósticas o musculares con dirección e intensidad adecuada sobre determinados puntos del cuerpo, como el punto pectoral (situado entre el 5º,6º o 7º espacio intercostal),en el volteo, y el punto de la tuberosidad del calcáneo del lado nucal y epicóndilo del lado facial,en la reptación, (Ver imágenes 4 y 5) y alternando los dos hemicuerpos del paciente, se obtienen unas respuestas específicas en la musculatura del individuo. La primera fase de volteo(39) (Imagen 5),permite el control del movimiento y de la postura mantenida sobre los puntos de apoyo y la extensión y rotación de cada uno de los segmentos de la columna vertebral, mejorando su movilidad funcional y el ensanchamiento de la caja torácica; por su parte, la postura de reptación,(39) posibilita el movimiento de paso de las extremidades libres, predispone a la consecución del patrón fisiológico de la marcha y aumenta la percepción del propio cuerpo (Imagen 6).
-Fisioterapia convencional:
 Se escogieron ejercicios globales de tipo pasivos, activos e incluso resistidos en aquéllos casos en los que la musculatura tenía normotono y un grado bueno de contractibilidad. Se caracterizaron por ser suaves y no muy repetitivos a fin de no fatigar la musculatura y obtener un efecto contraproducente. (40). Los ejercicios pasivos se introdujeron para disminuir la espasticidad muscular asociada si la hubiera (29,31,32,34).En algunos casos también se aplicaron métodos de termoterapia como la lámpara de infrarrojos, con el objetivo de aliviar y calmar las contracturas, masajes suaves para descargar grupos musculares doloridos, vendaje de vendaje neuromuscular para aumentar la irrigación muscular, TENS (Estimulación Eléctrica Nerviosa Transcutánea), como método analgésico en los pacientes que padecían dolores localizados, y otras técnicas en función de las necesidades, historia clínica y mejoría buscada en cada uno de los enfermos sometidos a tratamiento.
Se escogieron ejercicios globales de tipo pasivos, activos e incluso resistidos en aquéllos casos en los que la musculatura tenía normotono y un grado bueno de contractibilidad. Se caracterizaron por ser suaves y no muy repetitivos a fin de no fatigar la musculatura y obtener un efecto contraproducente. (40). Los ejercicios pasivos se introdujeron para disminuir la espasticidad muscular asociada si la hubiera (29,31,32,34).En algunos casos también se aplicaron métodos de termoterapia como la lámpara de infrarrojos, con el objetivo de aliviar y calmar las contracturas, masajes suaves para descargar grupos musculares doloridos, vendaje de vendaje neuromuscular para aumentar la irrigación muscular, TENS (Estimulación Eléctrica Nerviosa Transcutánea), como método analgésico en los pacientes que padecían dolores localizados, y otras técnicas en función de las necesidades, historia clínica y mejoría buscada en cada uno de los enfermos sometidos a tratamiento.
4. RESULTADOS.
Seguidamente se muestra la evaluación de los resultados obtenidos en las diversas pruebas realizadas.
Comparando los análisis de las valoraciones funcionales y los balances musculares pre y post tratamiento, no se han advertido diferencias notables entre ambas mediciones. En el balance, los principales grupos musculares correspondientes a miembros superiores, inferiores y tronco, conservaron prácticamente invariable la puntuación registrada, y en las valoraciones funcionales, los resultados fueron idénticos, de manera que no se han mencionado en el presente trabajo.
-Resultados espirométricos: Para interpretar los resultados de la espirometría, en primer lugar, se determinaron los valores considerados como referencia en función de los aspectos que pudieran influir en la cuantificación de los mismos como la edad media de la muestra, la talla, el peso y el sexo. En función de éstos, se establecieron comparaciones que permitieran delimitar el grado de afectación y las alteraciones en la actividad respiratoria. Así, se consideran normales para una edad media de 56,44 años(41), un Vc de aproximadamente 0,5 l, una CV de 3,50 l., un VRE de 1,2 l, una CVF de 3,01 l, una FEV1 o VEMS de 2,50 l y una relación FEV1/CVF (%),igual o superior al 70%(11).
Respecto a estos valores, en el estudio se ha observado una disminución de la CV, 2,87± 0,51 l antes de tratamientoà 2,57 ± 0,46 l, post-tratamiento en el grupo Vojta, frente a 3,11 ± 0,62 là 2,86 ± 0,44 l para el grupo fisioterapia; un decremento de la CVF: 2,65 ± 0,53 là 2,52 ± 0,4 l para el grupo terapia y 3,04 ± 0,59 l à 2,73 ± 0,50 l, para el grupo fisioterapia y un aumento del VEMS en el grupo Vojta: 2,17 ± 0,20 l à2,27 ± 0,31 frente a una disminución en el de fisioterapia: 2,7 ± 0,59 là
2,34 ± 0,45 l. El Vc tiende a unos valores normales : 1,02 ± 0,34 là 0,76 ± 0,22 l, en el grupo Vojta y 0,56 ± 0,13 l à0,6 ± 0,1 l en el grupo control. El VRE disminuye en los dos casos: 1,46 ± 0,47 là 0,93 ± 0,31 l en el grupo Vojta y 1,45 ± 0,39 là 1,39 ± 0,34 l. en el grupo fisioterapia. La relación FEV1/CVF % sitúa sus valores dentro de la normalidad : 86,48 ± 8,54 là 92,25 ± 3,16 l. para el Vojta y 87,75 ± 3,69 là 84,7 ± 6,56 l. para el grupo fisioterapia. (Tabla F).
Del análisis del conjunto de datos se deduce que la disminución con ambos tratamientos de los valores de CV, VRE, CVF, son reflejo de la no mejoría del estado de su capacidad respiratoria. Teniendo en cuenta que la CV resulta de la suma del VRE, el Vc y el VRI, el hecho de que haya disminuido el VRE induce a una limitación global de la CV, que depende del estado pulmonar y de la mecánica esquelética del paciente. Por otro lado, las cifras del VEMS, la CVF y la relación FEV 1/ CVF, indican un patrón respiratorio de tipo restrictivo, como se verá posteriormente.
-Resultados de la evaluación Electrofisiológica: Los resultados obtenidos se han comparado con los valores normales proporcionados por el Dr. D. Tomás Alburquerque, neurólogo y experto en la materia. Aunque las latencias del reflejo H y la respuesta F están relacionadas con la longitud de la pierna y por tanto con la estatura, se han considerado como normales los siguientes valores (Ver Tabla B). Como patrón general, aparece una latencia < 33 ms en la medición del Reflejo H sobre el trayecto del N. tibial posterior, valores que se ajustan en cierto modo a los obtenidos en dicho trabajo tanto pre como post-tratamiento y sin variaciones destacables entre ambos: pre-tratamiento Vojta, 22,68 ± 8,85 ms à 23,23 ± 9,01 ms., postratamiento, y pre-tratamiento fisioterapia, 22,8 ± 8,94 msà 23,63 ± 9,31 ms, tras el tratamiento.
Respecto a la onda F, cuya latencia media fisiológica es de < 56 ms, es similar a las cifras obtenidas en los enfermos de ELA. Probablemente, el grupo en el que haya habido un descenso mayor de estos valores normativos sea el grupo de fisioterapia post-tratamiento, en el que se anotó una latencia media de 35,75 ± 18,61 ms. respecto a la inicial de 39,85 ± 16,79 ms. (Ver Tabla E); en contraposición al grupo Vojta, que la conservó prácticamente estable (42,58 ± 17,83 ms. latencia inicial vs 40,03 ± 16,22 ms., latencia final). La persistencia de dicha onda, es similar a la considerada fisiológica, ≥ 20% (≥ 0,2) , con un descenso más notable de sus valores en el grupo de Vojta post-tratamiento, 28% aproximadamente (0,28 ± 0,18) respecto al preliminar de 56% (0,56 ± 0,30). Por su parte, en el grupo fisioterapia, la persistencia también decae de 67% aprox. (0,67 ± 0,26) como valor previo al tratamiento, a 44% como valor final. (0,44 ± 0,26).
El resto de parámetros como la onda M o la amplitud del potencial compuesto motor, sufren ligeras alteraciones cuantificadas en la valoración final. Si bien es cierto que los valores de la amplitud del potencial de acción compuesto motor, se reducirán según el grado de compromiso de afectación de la musculatura en la Enfermedad de Motoneurona (14), en el trabajo son desde el principio y sin sufrir apenas modificaciones posteriores, menores los correspondientes al grupo Vojta que al grupo fisioterapia. Teniendo en cuenta que se asignan los valores no patológicos de ≥ 2mV para la amplitud del potencial compuesto motor del N.peroneo, los resultados reunidos para éste, en general se encuentran bastante aproximados a los no patológicos, sobre todo en el grupo pre-tratamiento de ambas terapias. En el grupo Vojta se aumentan sus valores tras el tratamiento : 2,48 ± 0,97 mVà 3,15 ± 0,97 mV, y el grupo fisioterapia por el contrario, disminuye sus datos numéricos: 2,33 ± 1,67 mVà 1,83 ± 1,20 mV (Ver tabla E).
Prosiguiendo con el análisis de datos ,se considera normal una amplitud > 5 mV tanto para el N.mediano como para el N.cubital. En el N. Cubital, las cifras recogidas se asemejan correctamente a las normales: en el grupo Vojta los datos previos fueron 5,88 ± 2,63 m.V, y posteriores: 5,33 ± 2,59 mV mientras que para el grupo fisioterapia oscilaron de 6,4 ± 1,77 mV en el pre-tratamiento a 5,88 ± 1,99 mV en el post- tratamiento. Para el N.mediano, el grupo Vojta refiere unos valores de partida por debajo de lo normal 2,35 ± 2,12 Mv y se observa un ligero cambio, aunque apenas perceptible, en el post-tratamiento, 2,44 ± 1,39 mV. En el grupo fisioterapia los valores post-tratamiento respecto a los pre-tratamiento (de 6,28 ± 2,68 Mv a 5,6 ± 2,52 mV), han disminuido notablemente. (Ver tabla E). De la confrontación del compendio de datos de la amplitud del potencial compuesto motor se concluye que en la muestra de pacientes de ELA, tiene afectación tanto de miembros superiores como inferiores; afirmación que ha sido contrastada con los resultados generales obtenidos en el balance muscular.
| REFLEJO H (N.Tibial Posterior) |
ONDA F (Nervio Peroneo) |
|
|||
|
|
Latencia (ms) |
Persistencia (%) |
Nervio peroneo a músculo pedio |
Nervio mediano a abductor corto del pulgar: |
Nervio cubital a abductor del quinto dedo |
|
< 33 ms |
< 56 ms |
> 20% |
> 2 mV |
> 5 mV |
> 5 mV |
Tabla B. Valores normales del Estudio Electrofisiológico. Dr. D. Tomás López Alburquerque.
-Resultados en la plataforma dinamométrica: Para interpretar adecuadamente estos resultados primero hay que conocer la biomecánica y la función de los dos músculos explorados tanto en la marcha como en posición estática. El músculo tibial anterior es el antagonista del gastrocnemio; el primero realiza flexión dorsal (flexión de la planta del pie) e inversión del mismo, frente a la flexión plantar o extensión del pie llevada a cabo por el segundo. La contracción del tibial anterior estabiliza el tobillo, en particular, en el momento en que el pie hace contacto con el suelo durante la fase de apoyo en la marcha. Seguidamente lo eleva cuando la pierna se alza al caminar, y evita así arrastrar la punta del pie y ocasionar una marcha patológica. Los gastrocnemios funcionan como motor principal que propulsa el inicio de la marcha.(37,38)
- 1. Posición estática: En el exámen se ha incluido la actividad de los gastrocnemios y el tibial anterior pre y post- terapias y la actividad muscular comparativa de ambos (gráficas 1-6). Para mantener una postura estática correcta, a nivel muscular, debe de existir un equilibrio entre los músculos agonistas y antagonistas.(36) Se han advertido disparidades en los resultados hallados en cada una de las gráficas. Mientras que el tratamiento fisioterapéutico regula la actividad muscular de gastrocnemios, el Vojta incrementa notablemente sus valores respecto al pre-tratamiento, y la comparación de ambas respresentaciones (gráfica 3), es sorprendentemente diferente. Exactamente igual pero a la inversa se plasma en el tibial anterior, y el cotejo de ambas imágenes (gráfica 6), es totalmente opuesto. De esta manera, curiosamente puede decirse que mientras una terapia eleva la actividad muscular de un grupo concreto, la otra lo disminuye y al contrario. De todo ello se deduce que quizá por la acción que ejerce cada una de ellas, sería preciso una combinación de ambos tratamientos para estabilizar en cada caso un grupo muscular concreto (gastrocnemios con fisioterapia y tibial anterior con Vojta). Los picos que se registran en las gráficas sobre los primeros y últimos segundos, pudieran señalar una pérdida de equilibrio momentáneo del paciente.
| Los asteriscos muestran los resultados significativos en función de la prueba T.Student. * ≤ 0,05 ** ≤ 0,001 |



- 2. Patrones de marcha: De la revisión del patrón de marcha en los distintos grupos de tratamiento, y en función del músculo que se explore en cada caso, se han observado variaciones más regulares en la actividad de gastrocnemios del grupo fisioterapia post- tratamiento que en el pre-tratamiento, que mantiene una escasa activación de dicho músculo durante los segundos 3-5 y asciende posteriormente para disminuir al final. Sin embargo, cifras más dispares se han hallado en la gráfica post-tratamiento del grupo Vojta respecto a la inicial, con un importante decremento de los valores post-tratamiento. (Ver gráficas 7 y 9). En la actividad muscular de tibial anterior, aunque en los dos grupos aumenta considerablemente al final de los tratamientos, los valores preliminares del grupo Vojta, eran previamente más pequeños que los del grupo fisioterapia, hecho por el cual, las diferencias halladas en ambos casos son en el grupo terapia más significativas. En la comparación de los grupos de tratamientos (Ver gráficas 11 y 12), a lo largo de los diez segundos contabilizados, se advierte una marcha considerablemente más regular en cuanto a la actividad muscular general, en el grupo Vojta. Es destacable el descenso radical de los parámetros del grupo fisioterapia post- tratamiento en el tibial anterior, hasta alcanzar valores similares a los que tiene el grupo Vojta, sobre todo a partir de los segundos 6 y hasta el 10. (Ver gráfica 11). El correcto funcionamiento del músculo tibial anterior, evitaría el pie equino por inactividad de los extensores del tobillo. De esta forma, aunque el incremento de la actividad de éste haya sido brusco en el post-tratamiento de los dos casos (Ver gráficas 8 y 10), es preferible que haya aumentado respecto a los valores basales, considerablemente menores. Por el contrario, la actividad de gastrocnemios tiende a ser más regular, sobre todo en el grupo Vojta (Ver gráfica 9), que resulta en una mejoría sustancial de la marcha y en una correcta transferencia del peso corporal durante la misma.



-3. Superficie y carga de la base de sustentación: En la gráfica de superficie (Ver gráfica 13), en su mayoría, se han registrado ligeras mejorías en ambos grupos, aunque se partía de una situación más favorable para el grupo Vojta que para el de fisioterapia, lo que complica establecer una sentencia objetiva al respecto. Un aumento de la superficie del paciente en bipedestación en cm², con el fin de incrementar la estabilidad, supone una disminución del % de superficie, al alejarse paulatinamente del 100% que supondría una base sólida y firme de sustentación.
En la representación de la distribución de la carga, (considerada como el peso (kg) por unidad de superficie), y contando con que el 100% de ésta se relaciona con una óptima base de sustentación, no hay resultados positivos al haber decrecido los valores después del tratamiento en ambas terapias, tanto con los ojos abiertos (O.A) como cerrados (O.C); excepto en el grupo Vojta O.C, en el que los valores han aumentado discretamente, con toda probabilidad por las características del grupo (Ver gráfica 14).
Si se tiene en cuenta que el incremento de la extensión de la superficie, para un mismo peso en kg, resultará en un porcentaje menor de carga en cada punto de la superficie siguiendo una proporción inversa, cabe destacar que al incrementar los valores de superficie, debería esperarse una disminución proporcional de la carga y, sin embargo, esto no ocurre exactamente así.

-4. Elementos de la Marcha: Se han encontrado diferencias destacables entre el número de pasos por minuto post terapia Vojta respecto a la evaluación final del grupo fisioterapia (50,75 en el primer grupo frente a 38,67 en el segundo), aunque es cierto que los valores iniciales son diferentes: 66,5 pasos por minuto en el caso Vojta y 32,97 en el control (Ver gráfica 17). En la terapia Vojta se observa una disminución del número de pasos/ minuto (de 66,5 pre- tratamiento a 50,75 en el post-tratamiento), mientras que en la fisioterapia, ha habido un aumento entre el pre y el post- tratamiento de 32, 97 a 38,67 pasos por minuto. Por otra parte, se ha percibido una disminución en la distancia entre pasos en ambas terapias pero de forma más importante en el grupo post-fisioterapia, que pasa de 9,34 cm en el pre-tratamiento a 5 cm en el post- tratamiento. (Ver gráfica 19). Como se sabe, la distancia entre pasos está inversamente relacionada con el número de pasos por minuto, de manera que si crece la distancia entre el registro de las huellas de la plataforma dinamométrica, disminuye el número de pasos /minuto. Un ejemplo de ello, aunque sujeto a variables como el grado de afectación de cada paciente y otras características intrínsecas de la marcha, es el resultado de los miembros post-fisioterapia, donde el número de pasos por minuto ha aumentado y como consecuencia ha disminuido la distancia entre pasos.
En alusión al resto de parámetros, ni en la fuerza ni en el largo de paso ha habido variaciones entre el pre- y el post- tratamiento de las dos terapias.


5. DISCUSIÓN.
Una vez extraídos los resultados, se profundizará en su discusión, en la que se incluirán los aspectos más importantes del conjunto de evaluaciones.
En la Espirometría, a pesar de que es normal una disminución de la CV de 250 cc cada 10 años a partir de los 60 años(42), referencia próxima a la edad media de la muestra con la que se cuenta, se destaca que los datos obtenidos en conjunto son inferiores a los índices normales. (Ver tabla F). En cuanto al análisis aislado de la CVF, el VEMS y la relación FEV1/ CVF, contrastado con los datos no patológicos propuestos por Moriyón J.M(41), se concluye que la muestra de ELA presenta un patrón de tipo restrictivo generalizado, en el que tanto la CVF como la FEV1 se encuentran mermadas*,y por el contrarario, la relación VEF1/CVF(%) mantiene unos límites fisiológicos, sin cambio alguno trascendente en ninguno de los casos, lo que está en relación con las alteraciones respiratorias que habitualmente suceden en la ELA, ya que como dice Oliveira, A. S. B(19), muchos de estos enfermos mueren debido a fallos en el funcionamiento de la musculatura respiratoria, colapso de los alveolos, restricciones de la movilidad del tórax y presentan un patrón restrictivo progresivo.(41)
Para algunos autores(43,44), la CVF es un indicador de la supervivencia y de la progresión de la Enfermedad de Motoneurona debido a que se relaciona directamente con la función pulmonar y su descenso progresivo, y provoca importantes trastornos respiratorios en estos pacientes e incluso en ocasiones la muerte.
| TIPOS DE ALTERACIÓN ESPIROMÉTRICA | |||
|
PATRÓN |
CVF |
FEV 1 |
VEF 1/CVF |
|
*Restrictivo |
Disminuida |
Disminuida |
Normal |
|
Obstructivo con CVF normal |
Normal |
Disminuida |
Disminuida |
|
Obstructivo con CVF disminuída |
Disminuida |
Disminuida |
Disminuida |
Tabla C. Tipos de alteraciones espirométricas.(41)
En el estudio electrofisiológico , de acuerdo con Zarco. A. L(35), la amplitud del reflejo H está relacionada con la hiperexcitabilidad neuronal y por tanto con el grado de afectación central del sistema inhibidor descendente, vinculado a su vez con el síndrome piramidal o corticoespinal, hiperreflexia, hipertonía, presencia del Signo de Babinski,… etc. En relación al estudio, se han percibido subidas en la amplitud de H.máxima en el grupo de terapia Vojta (2,1 ± 1,27 mV inicialesà3,65 ± 2,20 mV finales), frente a una sutil disminución de la amplitud en el grupo fisioterapia (5,23 ± 3,57 mV inicialesà5,05 ± 3,32 mV finales), lo que podría inducir a un pequeño aumento de la excitabilidad de las Motoneuronas(14) en el grupo terapia. Ligado al tema, Motl et al.(45), concluyeron una reducción significativa del Reflejo H del Sóleo tras ejercicios activos y pasivos y sugirieron que esta atenuación del reflejo se causaría por aferencias de mecanorreceptores más que por influencias de comandos motores centrales. Consecuentemente, al final de su artículo sugieren que la actividad máxima voluntaria se mida con anterioridad y posterioridad a cualquier entrenamiento aplicado, y que se monitorice el electromiograma del músculo antagonista para restringir otros factores que puedan influir. Este trabajo coincide con esta propuesta de Motl en lo referente a su realización, si bien es cierto que sólo se ha constatado que la amplitud del reflejo H ha disminuido en el grupo fisioterapia.(Ver Tabla E).
En la valoración de la Onda F, en contraposición a lo anunciado por Carvalho y Swash(13) en el que afirma que en los pacientes con ELA se ha determinado un aumento notable de la latencia con una frecuencia normal y un incremento de la amplitud, en esta investigación, conocidos los valores fisiológicos para la latencia de la Onda F (Ver tabla A) , no se han observado valores distantes de la normalidad aunque sí un ligero aumento.(Ver tabla E). La amplificación de la latencia podría atribuirse a la pérdida de las motoneuronas de mayor tamaño, que a su vez son las que poseen un axón más grueso, y por tanto, las que conducen el impulso más rápidamente. En cuanto al aumento de la amplitud, podría asociarse con la descarga simultánea de varias motoneuronas debido a la hiperexcitabilidad central.
En la plataforma dinamométrica, y una vez analizados los resultados, en relación a los datos de posición estática, según Wiereszen(36) “el equilibrio del cuerpo está basado en un desequilibrio anterior, ya que el equilibrio perfecto del modelo postural aportaría demasiada inestabilidad. Así, cabe pensar que los factores estáticos estén localizados preferentemente hacia atrás para oponerse a ello”. También alude al equilibrio Álvarez Méndez A.M (46) con la siguiente cita : “el equilibrio se obtiene por la acción del trabajo ligamentoso, al que se agregan simples contracciones musculares, lo que se realiza con un mínimo consumo de energía y permite que el hombre pueda mantener durante gran parte del día una misma posición incluyendo la bipedestación…”. La primera referencia indica el predominio en estatismo de la actividad muscular en la cadena posterior mientras que la segunda defiende un mínimo consumo de energía y escasas contracciones musculares en el momento de la bipedestación. En el presente estudio, como se comentó en los resultados, puede decirse que mayoritariamente, la actividad registrada en ambos grupos musculares y durante la posición estática es excesiva, normalizándose en cierto modo en la evaluación post- tratamiento en los pacientes sometidos a la terapia Vojta frente al grupo fisioterapia, a la vez que se mantiene el enderezamiento del cuerpo en contra de la gravedad y el control del equilibrio y postura. No obstante, en la adquisición de una bipedestación estable, parece que juegua un papel más trascendente el músculo tibial anterior. Esto es, ante el riesgo de caída, es más probable que se opte por elevar los talones e inclinarse hacia atrás como mecanismo para evitarla,(proceso en el que actúa el tibial anterior) que encoger los dedos para tener mayor agarre o prensión (contracción efectuada por los gastrocnemios).
De la consulta de diversas fuentes bibliográficas sobre el estudio de la marcha, se incidirá en los elementos que la conforman. Autores como Collado Vázquez (37) catalogan éstos en velocidad, cadencia, longitud de zancada, longitud de paso, anchura de paso y ángulo de paso. Para él, la cadencia normal de la marcha suele ser de unos 90 pasos por minuto, de 70 pasos por minuto en marchas lentas y de hasta 130-150 pasos/ minuto, en rápidas. En el documento que se presenta, se ha obtenido una disminución leve del número de pasos por minuto con el tratamiento en el grupo Vojta (66,5 p/minà50,75p/min ), y un ligero aumento del número de pasos en el grupo Fisioterapia (32,97 p/minà38,67 p/min), ambos por debajo de lo normal. Las sutiles variaciones no son significativas ya que podrían deberse a dolores articulares, estado fisiológico y anímico del paciente en el momento de realización de las pruebas,…etc. Respecto a la longitud de zancada no patológica, Lehman(47) considera que es de 156 cms y la mitad para la longitud de paso. En base a los elementos recogidos para los enfermos de ELA, se tomará como referencia la longitud de paso y no la de zancada, es decir, un largo de paso de 78 cms. Según otros autores,(Ver tabla C) el largo de paso para la media de hombres y mujeres oscila entre 67,75 cms y 72,5 cms. En los sujetos con Enfermedad de Motoneurona, se ha recogido un largo de paso inicial de 40,75 cms para el grupo Vojta y 44,83 para el grupo fisioterapia, sin modificaciones apenas perceptibles en el post-tratamiento (Ver gráfica 16), cifras por debajo de la normalidad que hacen referencia a la marcha más lenta e inestable por alteración de la coordinación, el tono muscular.., con miedo a las caídas, que suelen tener estos pacientes, tal y como otros también afirman. (36,37,38)
|
|
Largo de paso (cm) |
|
Chao (1983) |
66 |
|
Kadaba (1990) |
67,75 |
|
Perry (1992) |
68,5 |
Tabla D. Valores normales para los distintos parámetros de marcha. Adaptación de la tabla de Collado,V,S.(37)
Sobre los tratamientos empleados en esta investigación, no existen artículos previos que constaten los beneficios de la terapia Vojta en la ELA, aunque sí en enfermedades musculares como las miopatías congénitas o aquéllas que cursan con retraso o alteraciones motoras(39)(Vojta, V, Peters,A, 1995). En contrapartida, son varios los autores que apuestan por la terapia física como tratamiento de la Enfermedad de la Motoneurona: Francis K (33), van Groenestijn, A (30), de Almeida, J. L (29), Simmons, Z. (31), Pozza, A. M.(32), Leigh, P. N (18),…y señalan progresos tales como una disminución de la espasticidad en la Escala de Ashworth, un estancamiento de la sintomatología y una mejora de la calidad de vida con la fisioterapia respiratoria, aunque coinciden en que sería necesario realizar más estudios sobre la materia.
Para finalizar la discusión, se considera importante resaltar todas las limitaciones que se han encontrado: una muestra pequeña y heterogénea de pacientes con distinta afectación y grado neurodegenerativo de la enfermedad, un espacio corto de tiempo de terapia y dificultades para una evaluación más regular y frecuente. A todo ello hay que añadir la pérdida parcial de objetividad en el análisis de los resultados porque, dada la naturaleza de este trabajo, uno de los examinadores ha conocido en todo momento la evolución del proceso. En el estudio electrofisiológico, a la hora de medir los parámetros pre y post- tratamiento con el instrumental, podrían influir levemente en la determinación de los resultados las ligeras diferencias de presión ejercidas en cada una de las exploraciones. Otro factor a tener en cuenta, es la complicación para el recuento de unidades motoras activas en el paciente antes de la terapia y su consiguiente comparación tras ella, dato que nos orientaría acerca de una evolución real del paciente. Por ello, aunque pudieran observarse pequeños cambios aparentemente positivos que nos llevaran a plantearnos, por ejemplo, una disminución de la hiperexcitabilidad de la vía cortical, no la podríamos confirmar.
Es difícil demostrar que las diferencias entre ambos grupos son estadísticamente significativas puesto que se parte de valores iniciales diferentes. Aún así, se puede concluir que la terapia Vojta ha influído positivamente en:
-Los análisis estáticos con la plataforma dinamométrica: ayuda a mantener la estabilidad del paciente, aumenta la actividad del tibial anterior y mejora el equilibrio y la postura.
-En la marcha: actúa regulándola, interviniendo sobre la actividad muscular.
-En el estudio electrofisiológico: mantiene estable alguno de sus parámetros y normaliza el grado de espasticidad de la musculatura.
Tras conocer las limitaciones que han surgido durante el estudio, queda la duda de cuáles habrían sido los resultados en otras circunstancias: una muestra más amplia con una designación y estratificación de cada grupo atendiendo al rango de gravedad de la enfermedad; la incidencia de estos tratamientos en los puntos donde se han apreciado beneficios y un protocolo estricto de actuación, supervisión y evaluación, contando con medidas estandarizadas y correctamente validadas que puedan evaluar los efectos positivos y negativos de las terapias, incluyendo medidas de función muscular o capacidad aeróbica, función y fatiga.(34)
6. CONCLUSIONES.
Tras el examen integral de los resultados, se extraen las siguientes conclusiones:
- La ELA es una enfermedad neuromuscular compleja, muy agresiva, destructora a diferentes niveles y en la que, a día de hoy, cualquier perspectiva de tratamiento se reduce al control de la sintomatología.
- De todas las pruebas realizadas, las que han proporcionado más información han sido la plataforma dinamométrica, el estudio electrofisiológico y la espirometría, ya que el resto de evidencias se han mostrado invariables y han impedido la cuantificación de resultados.
- Dado el pronóstico fatal de esta patología, se considera en cierta manera resultado positivo el hecho de que todos los pacientes evaluados hayan mantenido mediante algunos de los tratamientos escogidos, prácticamente estable su sintomatología.
-Estadísticamente no existen resultados significativos entre ambos grupos de tratamiento ni entre pre y post tratamiento intra-terapias. Las diferencias visibles se deben a la heterogenicidad de la muestra.
-Sería necesario realizar nuevos estudios en los que se contara con una muestra más grande y homogénea de pacientes con ELA, un periodo de tratamiento más amplio y un seguimiento más rutinario y controlado del paciente con evaluaciones más periódicas para la vigilancia del desarrollo de la enfermedad.
Finalmente, después de tomar contacto directo con esta enfermedad, quiero lanzar un mensaje de esperanza a los que la sufren, directa o indirectamente, y decirles que pronto llegarán tratamientos efectivos que mejoren su calidad de vida. Mientras tanto les deseo que conserven la ilusión por vivir.
7. REFERENCIAS.
*Los número asignados con un supra-índice se relación con su correspondiente referencia bibliográfica, según el orden de aparición en el texto.
1. Rowland, L. P., & Shneider, N. A. (2001). Amyotrophic lateral sclerosis. New England Journal of Medicine, 344(22), 1688-1700.
2.Ashley J Pratt, Elizabeth D Getzoff, and J Jefferson P Perry. “Amyotrophic lateral sclerosis: update and new developments”. Degener Neurol Neuromuscul Dis; 2012(2): 1–14. doi:10.2147/DNND.S19803.
3.Musarò A. “Understanding ALS: new therapeutic approaches” FEBS J. 2012 Dec 6. doi: 10.1111/febs.12087.
4.Metthew C Kiernan, Steve Vucic, Benjamin C Cheah, Martin R tumer, Andrew Eisen, Orla Hardiman, James R Burrell, Margaret C Zoing. “Esclerosis Lateral Amiotrófica, ELA”. The Lancet Neurology, 7 de Febrero de 2011, DOI: 10.1016/50140-6736(10)61156-7.
5.Brooks B. El Escorial World Federation of Neurology criteria for the diagnosis of Amyotrophic Lateral Sclerosis. Subcommittee on Motor Neuron Diseases/Amyotrophic Lateral Sclerosis of the world Federation of Neurology Research Group on Neuromuscular Diseases and the El Escorial “ Clinical limits of amyotrophic lateral sclerosis” workshop contributors. J.Neurol Sci 1994 (Suppl):96-107
6.Grosskreutz J. “MRI in amyotrophic lateral sclerosis: more than a promise”. J Neurol Neurosurg Psychiatry jnnp-2012-30323. Published Online First: 25 December 2012.
7.A.-M. Guennoc a, W. Camu b, P. Corcia. “Awaji criteria: New diagnostic criteria for amyotrophic lateral sclerosis”. Doi : 10.1016/j.neurol.2012.10.007.
8.Malhotra S, Pandyan AD, Day CR, Jones PW, Hermens. ” H.Spasticity, an impairment that is poorly defined and poorly measured”. Clin Rehabil. 2009 Jul;23(7):651-8. Epub 2009 May 26. Review.PMID: 19470550.
9.Voerman GE, Gregoric M, Hermens HJ Disabil Rehabil. “Neurophysiological methods for the assessment of spasticity: the Hoffmann reflex, the tendon reflex, and the stretch reflex”. 2005 Jan 7-21; 27(1-2):33-68.
10.Christie S, Lester S, LaPierre D, Gabriel DA.”Reliability of a new meas-ure of H-reflex excitability”. Clin Neurophysiol 2004; 115: 116-23.
11.Knikou. M. “The H-reflex as a probe: pathways and pitfalls”. Neurosci Methods. 2008 Jun 15;171(1):1-1. Epub 2008 Mar 4.. (12)
12.Yates C, Garrison K, Reese NB, Charlesworth A, Garcia-Rill E. “Chapter 11--novel mechanism for hyperreflexia and spasticity”. Prog Brain Res. 2011; 188:167-80.
13.de Carvalho, M., & Swash, M. (2000). Nerve conduction studies in amyotrophic lateral sclerosis. Muscle & nerve, 23(3), 344-352.
14.Cerrato, M., Bonell, C., & Tabernig, C. (2005). Factores que afectan el reflejo de Hoffmann en su uso como herramienta de exploración neurofisiológica. Revista de neurología, 41(6), 354-360.
15.Misiaszek, J. E. (2003). The H‐reflex as a tool in neurophysiology: Its limitations and uses in understanding nervous system function. Muscle & nerve, 28(2), 144-160.
16.Mesrati, F., & Vecchierini, M. F. (2004). F-waves: neurophysiology and clinical value. Neurophysiologie Clinique/Clinical Neurophysiology, 34(5), 217-243.
17.Kalina Venkova-Hristova, Alexandar Christov, Zarine Kamaluddin, Peter Kobalka, andKennethHensley. Erratum to “Progress in Therapy Development for Amyotrophic Lateral Sclerosis”. Neurology Research International Volume 2012, Article ID 853030, 2 pages. doi:10.1155/2012/853030.
18.Leigh, P. N., Abrahams, S., Al-Chalabi, A., Ampong, M. A., Goldstein, L. H., Johnson, J., ... & Willey, E. (2003). The management of motor neurone disease. Journal of Neurology, Neurosurgery & Psychiatry, 74(suppl 4), iv32-iv47
19.-Oliveira, A. S. B., & Pereira, R. D. B. (2009). Amyotrophic lateral sclerosis (ALS): three letters that change the people's life. For ever. Arquivos de Neuro-Psiquiatria, 67(3A), 750-782.
20.Gladman M, Cudkowicz M, Zinman L. “Enhancing clinical trials in neurodegenerative disorders: lessons from amyotrophic lateral sclerosis”. Curr Opin Neurol. 2012 Dec;25(6):735-42. doi: 10.1097/WCO.0b013e32835a309d.
21.Lee, C. T. C., Chiu, Y. W., Wang, K. C., Hwang, C. S., Lin, K. H., Lee, I. T., & Tsai, C. P. (2013). Riluzole and Prognostic Factors in Amyotrophic Lateral Sclerosis Long-term and Short-term Survival: A Population-Based Study of 1149 Cases in Taiwan. Journal of Epidemiology.
22.Gordon, P. H., Cheung, Y. K., Levin, B., Andrews, H., Doorish, C., Macarthur, R. B., ... & Scelsa, S. N. (2008). A novel, efficient, randomized selection trial comparing combinations of drug therapy for ALS. Amyotrophic Lateral Sclerosis, 9(4), 212-222.
23.Qureshi, M., Schoenfeld, D. A., Paliwal, Y., Shui, A., & Cudkowicz, M. E. (2009). The natural history of ALS is changing: improved survival. Amyotrophic Lateral Sclerosis, 10(5-6), 324-331.
24.Sorenson, E. J., Windbank, A. J., Mandrekar, J. N., Bamlet, W. R., Appel, S. H., Armon, C., ... & Thornton, C. A. (2008). Subcutaneous IGF-1 is not beneficial in 2-year ALS trial. Neurology, 71(22), 1770-1775.
25.McGeer, E. G., & McGeer, P. L. (2005). Pharmacologic approaches to the treatment of amyotrophic lateral sclerosis. BioDrugs, 19(1), 31-37.
26.Verstraete, E., Veldink, J. H., Huisman, M. H., Draak, T., Uijtendaal, E. V., van der Kooi, A. J., ... & van den Berg, L. H. (2012). Lithium lacks effect on survival in amyotrophic lateral sclerosis: a phase IIb randomised sequential trial. Journal of Neurology, Neurosurgery & Psychiatry, 83(5), 557-564.
27.Keller AF, Gravel M, Kriz J. Treatment with minocycline after disease onset alters astrocyte reactivity and increases microgliosis in SOD1 mutant mice. Exp Neurol. 2011;228:69-79.
28.Blanquer M, Moraleda JM, Iniesta F, et al. Neurotrophic bone marrow cellular nests prevent spinal motoneuron degeneration in amyotrophic lateral sclerosis patients: a pilot safety study. Stem Cells. 2012 Jun;30(6):1277-85. doi: 10.1002/stem.1080
29.de Almeida, J. L., Silvestre, R., Pinto, A. C., & de Carvalho, M. (2012). Exercise and amyotrophic lateral sclerosis. Neurological Sciences, 33(1), 9-15.
30.Van Groenestijn, A., van de Port, I., Schröder, C., Post, M., Grupstra, H., Kruitwagen, E., ... & Lindeman, E. (2011). Effects of aerobic exercise therapy and cognitive behavioural therapy on functioning and quality of life in amyotrophic lateral sclerosis: protocol of the FACTS-2-ALS trial. BMC neurology, 11(1), 70.
31.Simmons, Z. (2012). Rehabilitation of motor neuron disease. Handbook of clinical neurology/edited by PJ Vinken and GW Bruyn, 110, 483-498.
32.Pozza, A. M., Delamura, M. K., Ramirez, C., Valério, N. I., Marino, L. H. C., & Lamari, N. M. (2006). Physiotherapeutic conduct in amyotrophic lateral sclerosis. Sao Paulo Medical Journal, 124(6), 350-354.
33.Francis, K., Bach, J. R., & DeLisa, J. A. (1999). Evaluation and rehabilitation of patients with adult motor neuron disease. Archives of physical medicine and rehabilitation, 80(8), 951-963.
34.DalBello‐Haas, V., Florence, J., & Krivickas, L. (2008). Therapeutic exercise for people with amyotrophic lateral sclerosis/motor neuron disease. The Cochrane Library.
35.Zarco A.L. (2003) Bases neurofisiológicas de la conducción nerviosa y la contracción muscular y su impacto en la interpretación de la neuronografía y la electromiografía. Asociación Colombiana de Neurología.
36.Wiereszen I. Natalia (2005).Análisis de la Actividad Muscular en posición bípeda y durante la Marcha. Departamento de Fisiología. Universidad del País Vasco.
37.Collado Vázquez, S. (2004). Análisis de la marcha humana con plataformas dinamométricas: influencia del transporte de carga (Doctoral dissertation, Universidad Complutense de Madrid, Servicio de Publicaciones).
38.Viladot, A et al. Quince lecciones sobre patología del pie. Springer- Verlag Ibérica, Barcelona 2000.
39.Bauer, H., Appaji, G., & Mundt, D. (1992). Vojta neurophysiologic therapy. The Indian Journal of Pediatrics, 59(1), 37-51.
40.Clarissa Ramirez, Maria Elisa Pimente Piemonte1, Dagoberto Callegaro and Helga Cristina Almeida Da Silva. “Fatigue in amyotrophic lateral sclerosis: Frequency and associated factors” .2008, Vol. 9, No. 2, Pages 75-80 (doi:10.1080/17482960701642502
41.Moriyón JM. En Med Mar: Exploración funcional pulmonar en el trabajador del mar. Espirometría [Formación Continuada]. Medicina Marítima. 1997 Jun; 1 (4): 185-190.
42.Méndez, F. G. R., Almada, P. U., Barquera, S., Jiménez, L. G. O., Pérez, J. L. E., Navarro, M. A. P., & Guzmán, L. C. M. (2001). c. et al. valores espirométricos y gasométricos en una población geriátrica sana, a diferentes alturas sobre el nivel del mar, en la república mexicana* estudio multicéntrico. Rev Inst Nal Enf Resp Mex, 14(2), 90-98.
43.Czaplinski, A., Yen, A. A., & Appel, S. H. (2006). Forced vital capacity (FVC) as an indicator of survival and disease progression in an ALS clinic population. Journal of Neurology, Neurosurgery & Psychiatry, 77(3), 390-392.
44.Salord, N., Miralda, R. M., & Casan, P. (2002). Evolución de la esclerosis lateral amiotrófica a través de la función pulmonar. Arch Bronconeumol, 38(9), 452-454
45.Motl, R. W., Knowles, B. D., & Dishman, R. K. (2003). Acute bouts of active and passive leg cycling attenuate the amplitude of the soleus H-reflex in humans. Neuroscience letters, 347(2), 69-72.
46.Angulo Carrere, M. T., & Álvarez Méndez, A. (2009). Biomecánica de la extremidad inferior. 5. Exploración de las articulaciones del pie.
47.Lehmann, J. F., & De Lateur, B. J. (1999). Análisis de la marcha: diagnóstico y manejo. Krusen: Medicina física y rehabilitación. Madri: Editorial Médica Panamericana, 108-26.
•Libros de referencia:
- 1. Vojta, V, Peters,A (1995 ). El principio Vojta. Editorial: Springer Verlag Ibérica.
- 2. Netter, F. H. (2010). Atlas of human anatomy. Editorial: Saunders.
- 3. Vojta, V., & Schweizer, E. (2011). El descubrimiento de la motricidad ideal. Madrid: Morata.
-4. Cordova, A. (2003). Fisiología dinámica. Masson.
- ANEXOS:





